分析:(1)该有机物为烷烃,主链有7个碳原子,从左端或右端开始编号,3号、5号碳上各有2个碳原子;
(2)键线式是只键线来表示碳骨架,分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略,而其他杂原子及与杂原子相连的氢原子须保留;
(3)乙醛与新制氢氧化铜发生反应生成乙酸、氧化亚铜和水;
(4)酯化反应原理为:酸去羟基醇去氢,据此解答;
(5)A.制乙烯时,温度计测量的是混合液的温度;
B.溴苯不易氧化;
C.硫酸能够与硝酸银溶液反应生成沉淀,干扰氯离子的检验;
D.做过银镜反应的试管用稀硝酸洗;
E.甲醛与新制的氢氧化铜反应必须在碱性环境下.
(6)①依据官能团的结构判断解答;
②有机物甲的分子式为C
9H
10O,不饱和度为:
=5,结合苯环上有两个不同的取代基,能与Br
2的CCl
4溶液发生加成反应说明存在碳碳双键,遇FeCl
3溶液显呈现紫色,说明存在酚羟基;
③依据反应物和生成物的结构特点判断反应的类型;依据反应条件铜做催化剂与氧气反应可知该反应为醇被氧化;
(7)根据质谱图可知该有机物的相对原子质量为74,由红外光谱图可看出该分子中有不对称CH
3,因此该分子中有2个CH
3,由图也可以看出含有C=O双键,C-O-C单键,据此书写A的结构简式;
(8)有机物能与金属Na反应产生无色气体,说明含有-OH或-COOH;又能与碳酸钠反应产生无色气体,说明含有-COOH;还可以使溴的四氯化碳溶液褪色,说明含有不饱和键
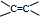
或-C≡C-,根据含氧元素的质量分数为37.21%,相对分子质量不超过100,确定分子中氧原子个数,进而确定有机物的相对分子质量,确定有机物的分子式.根据核磁共振氢谱确定分子中氢原子类型,结合可能的官能团,确定有机物结构.
解答:
解:(1)该烷烃的系统命名为:3,3,5,5-四甲基庚烷,故答案为:3,3,5,5-四甲基庚烷;
(2)4-甲基-1-戊烯的键线式为:
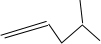
,故答案为

;
(3)乙醛与新制氢氧化铜发生反应生成乙酸、氧化亚铜和水,方程式为:CH
3CHO+2Cu(OH)
2CH
3COOH+Cu
2O↓+2H
2O;
故答案为:CH
3CHO+2Cu(OH)
2CH
3COOH+Cu
2O↓+2H
2O;
(4)苯甲酸甲酯是由苯甲酸和甲醇通过酯化反应生成,应产物水分子中有同位素
18O,依据酯化反应原理酸去羟基醇去氢,可知苯甲酸中羟基氧原子为
18O,反应的化学方程式为:C
6H
5-CO
18OH+CH
3OH
C
6H
5-COOCH
3+H
218O;
故答案为:C
6H
5-CO
18OH+CH
3OH
C
6H
5-COOCH
3+H
218O;
(5)A.制乙烯时,温度计测量的是混合液的温度,应插入液面以下,故A正确;
B.实验室用溴和苯在铁粉存在下反应,得到的溴苯显褐色,原因是溴苯中溶解溴,与在空气中被氧化无关,故B错误;
C.硫酸能够与硝酸银溶液反应生成沉淀,干扰氯离子的检验,故C错误;
D.做过银镜反应的试管用稀硝酸洗,故D错误;
E.甲醛与新制的氢氧化铜反应必须在碱性环境下,故E错误,
故选:BCDE;
(6)①甲和乙中含氧官能团的名称分别为羟基和醛基;
故答案为:羟基、醛基;
②根据条件可知有机物甲的同分异构体,有5个不饱和度,含有1个苯环,1个碳碳双键,1个酚羟基,结构简式为:
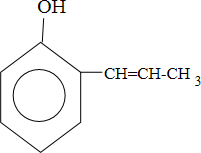
,
故答案为:

;
③反应甲
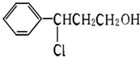
,可知反应过程中甲分子中的碳碳双键断裂与HCl发生加成反应;

Y,反应过程中醇羟基被氧化为醛基,Y的结构简式为:
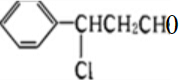
,
故答案为:

;
(7)质谱图可知该有机物的相对原子质量为74,由红外光谱图可看出该分子中有不对称CH
3,因此该分子中有2个CH
3,由图也可以看出含有C=O双键,C-O-C单键,可得分子的结构简式为:CH
3COOCH
3;
故答案为:CH
3COOCH
3;
(8)有机物中氧元素的质量分数为37.21%,相对分子质量不超过100,所以分子中氧原子数目N(O)<
=2.3,该有机物能与碳酸钠反应产生无色气体,说明含有-COOH,所以碳原子数为2,可知其相对原子质量为:
=86,又因为B完全燃烧只生成CO
2和H
2O,所以只含有碳、氢、氧三种元素,设其化学式为:CaHb-COOH,有B的相对分子质量为86可知,CaHb-的式量为12a+b=41,若a=1,则b=29不符合烃基结构;若a=2,则b=17不符合烃基结构;若a=3,则b=5成立,故该有机物的分子式为C
4H
6O
2,B分子式为C
4H
6O
2,不饱和对为
=2,含有一个羧基,且B能够使溴的四氯化碳溶液褪色,所有还应有1个碳碳双键,从核磁共振检测发现B的氢谱可知B有三种布同环境下的氢原子,所以其结构简式为:CH
2=C(CH
3)-COOH,
故答案为:CH
2=C(CH
3)-COOH.

 系统命名为
系统命名为



 或-C≡C-,根据含氧元素的质量分数为37.21%,相对分子质量不超过100,确定分子中氧原子个数,进而确定有机物的相对分子质量,确定有机物的分子式.根据核磁共振氢谱确定分子中氢原子类型,结合可能的官能团,确定有机物结构.
或-C≡C-,根据含氧元素的质量分数为37.21%,相对分子质量不超过100,确定分子中氧原子个数,进而确定有机物的相对分子质量,确定有机物的分子式.根据核磁共振氢谱确定分子中氢原子类型,结合可能的官能团,确定有机物结构. ,故答案为
,故答案为 ;
; ,
, ;
; ,可知反应过程中甲分子中的碳碳双键断裂与HCl发生加成反应;
,可知反应过程中甲分子中的碳碳双键断裂与HCl发生加成反应;
 ,
, ;
;

 名校课堂系列答案
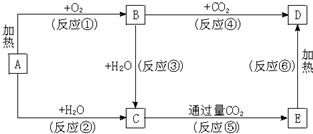
名校课堂系列答案 A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的.
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的.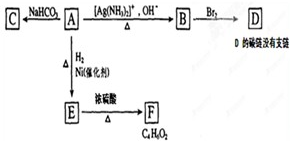
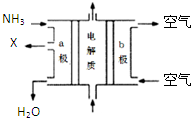 工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.
工业废水中含有多种有害成分,任意排放将造成严重污染,进行分类处理达标后才能排放.