
2015年10月,浙江籍科学家屠呦呦因发现青蒿素(C15H22O5)而获得诺贝尔生理学或医学奖。根据物质的分类,青蒿素属于( )
A.碱性氧化物 B.有机物 C.含氧酸盐 D.酸性氧化物
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.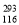 Lv的相对原子质量为293
Lv的相对原子质量为293
B.H2O的稳定性大于H2S ,是因为水分子间存在氢键
,是因为水分子间存在氢键
C.某物质中含有极性键,则该物质不可能是单质
D.元素的非金属性越强,其气态氢化物水溶液的酸性越强
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:填空题
碳、硫和氮元素及其化合物的处理,是资源利用和环境保护的重要研究课题。
(1)CO可转化成二甲醚,原理为:2CO(g)+4H2(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线

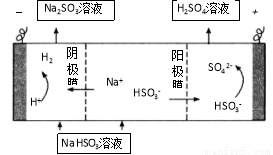
若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”);
(2)SO2的水溶液呈酸性,某温度下,0.02mol·L-1亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离常数Ka1= 。
(3)已知:反应1:2SO2(g)+O2(g)  2SO3(g) ΔH1;
2SO3(g) ΔH1;
反应2:2NO(g)+O2(g)  2NO2(g) ΔH2;
2NO2(g) ΔH2;
若ΔH1<ΔH2<0,则反应3:SO2(g)+NO2(g)  SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
(4)若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图(见右图)。电解时阳极的电极反应式为 。
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g)+NO2(g)  SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。
SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。

查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.二氧化锰和浓盐酸反应:MnO2+4HCl(浓) Mn2++2Cl2↑+ 2H2O
Mn2++2Cl2↑+ 2H2O
B.稀盐酸和硅酸钠溶液反应:SiO32-+2H+=H2SiO3↓
C.碳酸钙和稀盐酸反应:CO32-+2H+=CO2↑+H2O
D.铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.氯气可用于自来水的消毒 B.二氧化硅是半导体材料
C.氢氧化铁胶体能用于净水 D.二氧化硫可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验能成功的是( )
①用灼烧法鉴别Na2CO3固体和NaHCO3固体
②用观察法区别Na2O粉末和Na2O2粉末
③用AlCl3溶液鉴别Na2CO3溶液和NaOH溶液
④用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
A.全部 B.①②④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2017届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:填空题
一氧化碳和二氧化硫是用途广泛的化工基础原料。
(1)已知:C(s)+O2(g)=CO2(g) △H1=– 393.5 kJ·mol – 1
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol – 1
S(s)+O2(g)=SO2(g) △H3=– 296.0 kJ·mol – 1
已知某反应的平衡常数 ,据以上信息,请写出该反应的热化学反应方程式: 。
,据以上信息,请写出该反应的热化学反应方程式: 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)  CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
(3)工业利用反应2SO2(g)+O2(g)  2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体密度保持不变
c.SO2和O2的物质的量之比保持不变
d.每消耗1 mol SO3的同时,生成0.5 mol O2
(4)下图中A装置为熔融盐燃料电池的工作原理示意图。某课外活动小组用下图所示装置通过电解生成Fe(OH)3进行水的净化。

①已知该燃料电池负极的电极反应是CH4+4CO32--8e- = 5CO2+2H2O。
则正极的电极反应式是 。
电解池B阳极的电极反应式为 。
②实验过程中,若在阴极产生了22.4 L(标准状况)气体,则熔融盐燃料电池消耗CH4 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2017届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是( )
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是( )
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三上9月月考化学试卷(解析版) 题型:实验题
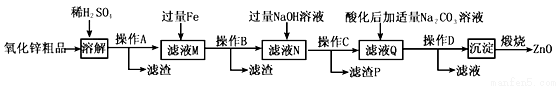
活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)为原料制备活性氧化锌并生产其它副产品的生产工艺流程如下:
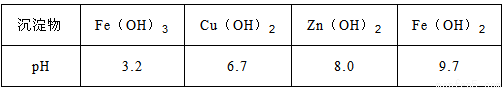
已知:Zn(OH)2可溶于NaOH溶液。一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
(1)操作A所用的玻璃仪器有烧杯、漏斗和______________。
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是____________________。
(3)加入过量铁可回收的金属是_______________。
(4)常温下若向滤液N中加入适量的H2O2溶液,再加一定量某试剂调节溶液pH=5,则Fe3+浓度为__________(已知Ksp[Fe(OH)3]=4.0×10-34)
(5)用K3[Fe(CN)6](铁氰化钾)验证N中Fe2+的现象是___________。
(6)“沉淀”的成分为ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为_____________________。
(7)取20.00mL滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com