
科目:高中化学 来源:不详 题型:判断题
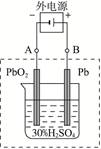
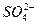
 2PbSO4+2H2O
2PbSO4+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
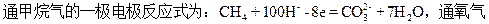
| A.阴极:4H2O+2O2+8e=8OH- |
| B.正极:4H2O+2O2+8e=8OH- |
| C.阴极:4OH--4e=2H2O+O2↑ |
| D.正极:4OH--4e=2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增加0.8 g | B.增加6.4 g |
| C.减轻6.4 g | D.增加5.6 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.锌片是正极,铜片上有气泡产生 | B.电流方向是从锌片流向铜片 |
| C.溶液中H2SO4的物质的量减少 | D.电解液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
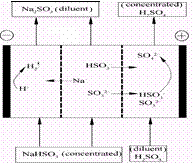
| A.阳极区酸性增强 |
| B.阴极区电极反应式为:2H++2e—=H2↑ |
| C.diluent和concentrated的中文含义为浓缩的、稀释的 |
| D.该过程中的副产品主要为H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 1 |
| 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com