
| A. | 硫铁矿煅烧前需适当粉碎,目的是增大反应物转化率 | |
| B. | 沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应 | |
| C. | 接触室中使用热交换器,主要目的是提高SO2的转化率 | |
| D. | 吸收塔中用98.3%硫酸吸收SO3,目的是防止形成酸雾,SO3使吸收完全 |
分析 制硫酸原料为硫铁矿,进样前首先将硫铁矿粉碎,增大接触面积;生产分三步,二氧化硫的制取和净化、二氧化硫转化为三氧化硫、三氧化硫的吸收,分别在沸腾炉、接触室、吸收塔中进行;其中从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒,在接触室中的催化剂可以加快反应的速率,但不会影响平衡的移动,二氧化硫的转化率不会改变;在吸收塔中生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全,以此解答该题.
解答 解:A.硫铁矿煅烧前需适当粉碎,目的是增大反应速率,但转化率不变,故A错误;
B.从沸腾炉出来的炉气需净化是因为其中带有的杂质气体会让下一步接触室里面的催化剂中毒,催化剂中毒会影响反应的进度,故B错误;
C.接触室中使用热交换器,可有效利用热量,提高反应速率,但转化铝不能增大,故C错误;
D.生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全,故D正确;
故选D.
点评 本题考查了工业上接触法制硫酸的原料、过程,明确发生的化学反应及设备、原料、在生产实践中采用98.3%的浓硫酸吸收的原因是解答本题的关键,并注意理论与实际生产中的差别来解答.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
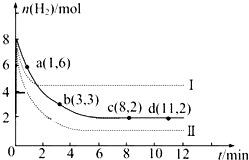 工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D均为含苯环的有机物,且式量B>A>C.
A、B、C、D均为含苯环的有机物,且式量B>A>C. .
. .
. 、
、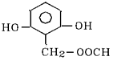 、
、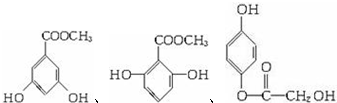 (其中的任意2种).
(其中的任意2种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合溶液中逐滴加入0.1mol/l是H2SO4溶液 | |
| B. | 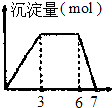 向含0.1mol/L的AlCl3和0.3mol/LNH4Cl的1L混合溶液中逐滴加入0.1mol/l是NaOH溶液 | |
| C. | 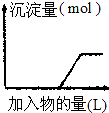 向烧碱溶液中逐滴加入明矾溶液 | |
| D. | 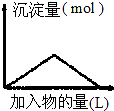 向Ba(OH)2溶液中逐渐通入二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P2O5可用于干燥Cl2和NH3 | |
| B. | 用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 通过浓硫酸除去HCl中的H2O | |
| D. | 通过灼热的CuO除去H2中的CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被还原的H2SO4为0.2moL | |
| B. | 反应中共转移电子0.1moL | |
| C. | 反应消耗了金属Cu6.4g | |
| D. | 生成的CuSO4配成500mL溶液,浓度为1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com