
| A、相同浓度的两溶液中c(H+)相同 |
| B、100 mL 0.1 mol/L的两溶液分别与氢氧化钠反应至恰好呈中性,盐酸需要的氢氧化钠的物质的量多 |
| C、pH=3的两溶液稀释100倍,醋酸pH变化大 |
| D、两溶液中分别加入少量对应的钠盐固体,c(H+)均明显减小 |


科目:高中化学 来源: 题型:
| 化学式 | 电离常数(25℃) |
| HCN | K=5.0×10-10 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A、等浓度等体积的NaCN、NaHCO3溶液混合:c(Na+)+c(H+)=c(HCO3-)+c(CN-)+c(OH-)+2c(CO32-) | ||
B、若NaCN的水解平衡常数为:Kh=
| ||
| C、等浓度等体积的NaCN和NaCl溶液中离子数目前者大于后者 | ||
| D、过量CO2通入NaCN溶液中:CO2+H2O+CN-=HCO3-+HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉的有效成分是Ca(ClO)2 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸易挥发 |
| C、绿色食品是不含任何化学物质的食品 |
| D、在空气质量日报中CO2属于污染物. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH属于强电解质是因为其可以完全电离 |
| B、电解质溶液可以导电是因为溶液中存在自由移动的离子 |
| C、工业上用电解熔融的氯化铝来制备金属铝 |
| D、碳酸钠溶液与澄清石灰水反应的离子方程式可表示为:Ca2++CO32-=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
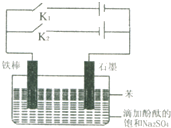 同学用电解原理设计一个观察Fe(OH)2沉淀和Fe(OH)2被氧化的实验装置.如图所示,有关该装置的说法正确的是( )
同学用电解原理设计一个观察Fe(OH)2沉淀和Fe(OH)2被氧化的实验装置.如图所示,有关该装置的说法正确的是( )| A、断开K2,接通K1,铁棒和石墨棒上都放出大量气泡,两电极附近溶液颜色均无变化 |
| B、断开K2,接通K1,仅石墨捧上放出大量气泡,石墨电极附近溶液变红,一段时间后水槽中可见白色沉淀生成且保持较长时间不变色 |
| C、断开K2,接通K1,一段时间后再断开K1,接通K2,由于苯层的保护作用,白色沉淀仍能长时间保持不变色 |
| D、若先断开K1,接通K2,铁棒和石墨棒上都放出大量气泡,石墨电极附近溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的pH=4 |
| B、此溶液中,HA约有0.1%发生电离 |
| C、加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大 |
| D、由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g) | ||
B、C2H2(g)+
| ||
C、C2H2(g)+
| ||
D、C2H2(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度为0.5 mol/L的MgCl2溶液,含有Cl- 个数为NA |
| B、V mL硫酸铁溶液中含有mg SO42-,则Fe3+的物质的量浓度为6.94m/V mol?L-1 |
| C、将58.5 g NaCl溶解于1 L水中配成溶液,所得溶液的物质的量浓度为1 mol?L-1 |
| D、用36.5%的浓盐酸(密度为1.25g?cm-3)配制成浓度为0.1mol?L-1的稀盐酸240ml,所需浓盐酸的体积为1.9mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com