
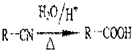 ,回答问题:
,回答问题: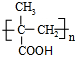 .
.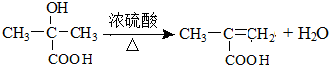 .
.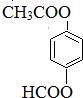 (只写一种).
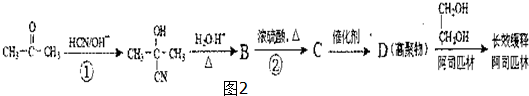
(只写一种). 分析 根据题中各物质的转化关系可知,丙酮与HCN在碱性条件下发生加成反应生成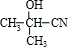 ,再发生水解反应得到B为(CH3)2C(OH)COOH,B发生消去反应得到C为CH2=C(CH3)COOH,C发生加聚反应得到聚合物D为
,再发生水解反应得到B为(CH3)2C(OH)COOH,B发生消去反应得到C为CH2=C(CH3)COOH,C发生加聚反应得到聚合物D为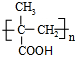 ,据此答题.
,据此答题.
解答 解:根据题中各物质的转化关系可知,丙酮与HCN在碱性条件下发生加成反应生成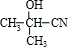 ,再发生水解反应得到B为(CH3)2C(OH)COOH,B发生消去反应得到C为CH2=C(CH3)COOH,C发生加聚反应得到聚合物D为
,再发生水解反应得到B为(CH3)2C(OH)COOH,B发生消去反应得到C为CH2=C(CH3)COOH,C发生加聚反应得到聚合物D为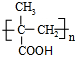 ,
,
(1)根据上面的分析可知,B为(CH3)2C(OH)COOH,含有的官能团为羟基和羧基,反应②为消去反应,
故答案为:羟基和羧基;消去反应;
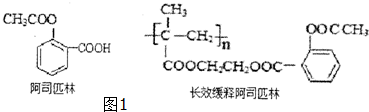
(2)根据阿司匹林的结构简式可知,
A.阿司匹林中有氧元素,所以不属于芳香烃,故A错误;
B.阿司匹林的分子式为C9H8O4,故B错误;
C.阿司匹林中有羧基,所以能与NaHCO3溶液反应生成无色气体二氧化碳,故C正确;
D.在酸性条件下水解生成酚羟基,可使三氯化铁溶液溶液显紫色,故D正确,
故答案为:CD;
(3)根据上面的分析可知,D的结构简式为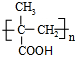 ,故答案为:
,故答案为: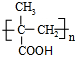 ;
;
(4)B→C反应的化学方程式为 ,
,
故答案为: ;
;
(5)有机物A是阿司匹林的同分异构体,具有如下特征:①苯环含有对二取代结构②能发生银镜反应,说明有醛基,③能发生水解反应且产物中的2种为同系物或同种物质,符合这样条件的有机物为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断与合成,根据阿司匹林与长效缓释阿司匹林的结构推断D的结构是解题的关键,注意对反应信息的利用,需要学生根据转化关系判断,注重对学生的自学能力、理解能力、分析归纳能力、知识迁移能力的考查.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取7.6g硫酸铜,加入500 mL的水 | B. | 称取8.0g硫酸铜,配成500mL溶液 | ||
| C. | 称取12.0g胆矾,配成500mL溶液 | D. | 称取12.5g胆矾,加入500mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
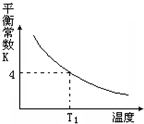 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
| Y | 2 | 1.80 | 1.66 | … | … | … | … |
| A. | 前5min用Z表示的平均反应速率为0.2 mol/(L•min) | |
| B. | 该反应的正反应是吸热反应,且T1>T | |
| C. | 若温度为T1时,以同样的起始量反应,达到平衡时X的转化率约为66.7% | |
| D. | 在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的转化率仍为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
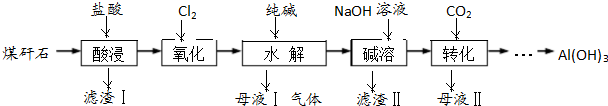
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
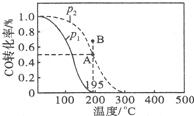 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合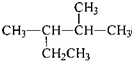 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛,完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: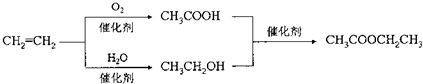 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li的原子结构示意图为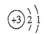 | B. | 原子半径:P>S | ||
| C. | 酸性:H3PO4<H2SO4 | D. | Li、Ge、P、S都属于短周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
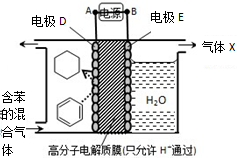
| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电极→B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com