
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能检验出一定存在的离子是( )
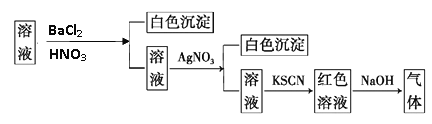
A. SO42-、NH4+ B. Cl- C. Fe3+ D. NH4+
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是

A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润淀粉KI试纸未变蓝说明SO2的还原性弱于I2
D.品红试纸、沾有KMnO4溶液滤纸均褪色都能证明SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
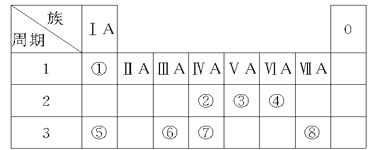
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号)_______。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________。
(3)①、④、⑤三种元素可形成既含离子键又含共价键的化合物,写出该化合物的电子式________。
(4)②的氧化物的结构式_________;比较②、⑦的氧化物的熔点(填化学式):
______>_______,原因是___________________________________________。
(5)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。
①Be(OH)2与Mg(OH)2可用__________鉴别(填名称)。
②写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确、且能达到目的的是
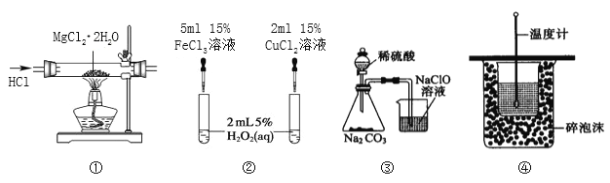
A. 实验①,制取无水MgCl2
B. 实验②,用于比较Fe3+和Cu2+对H2O2分解的催化效果
C. 实验③,验证酸性的强弱,H2SO4>H2CO3>HClO
D. 实验④,进行中和热的测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:
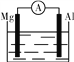
①
(1)如图①,若烧杯中溶液为稀硫酸,则观察到的现象是
________________________________________________________________________;
若烧杯中溶液为氢氧化钠溶液,则负极的电极反应式为____________________。
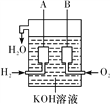
②
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图②所示:A、B两个电极均由多孔的碳块组成。该电池的正极为________(填“A”或“B”);
如果将图②装置中通入的H2改成CH4气体也可以组成一个原电池装置电池的总反应方程式为CH4+2O2+2KOH===K2CO3+3H2O,则该电池的负极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号都代表一种元素,请根据要求回答问题:
族 周期 | IA | 0 | |||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | Ne | ||||||
3 | ③ | ④ | ⑤ | ⑥ | |||||
(1)元素①的最低价氢化物和最高价氧化物的水化物反应得到一种离子化合物的化学式为________________;
(2)②和⑥两种元素的原子半径大小关系:②________⑥(填“>”或“<”);
(3)③和⑤两种元素的金属性强弱关系:③________⑤(填“>”或“<”),它们的最高价氧化物对应水化物反应的离子方程式为__________________________________________;
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
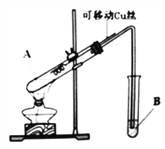
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
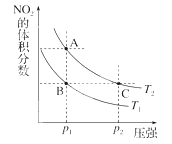
A.若恒温恒容时充入氩气,平衡向逆反应方向移动。
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.因为B、C两点NO2的体积分数相同,所以化学平衡常数KB = KC
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com