

分析 由流程可知,I中发生2CaCO3+O2+2SO2=2CaSO4+2CO2,反应Ⅳ为NH4HCO3、CaSO4、NH3反应生成碳酸钙和硫酸铵,发生NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4,可知CaCO3、CO2可循环使用,反应Ⅴ为硫酸铵溶液中加入氯化钾生成硫酸钾晶体,所以操作b为过滤,滤液中含有的阳离子为铵根离子,Ⅱ中发生SO2+2NH3.H2O=(NH4)2SO3+H2O,Ⅲ中发生CaSO4+4C=CaS+4CO↑,
(1)碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,根据反应物和生成物写出反应的化学方程式;
(2)亚硫酸氨中的硫为+4价,易被空气中的氧气氧化;
(3)反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,根据元素的化合价变化来分析氧化剂及还原剂,氧化剂为CaSO4,还原剂为C,利用化学反应方程式来分析氧化剂与还原剂的物质的量之比,温度过高NH4HCO3分解;
(4)利用硫酸钾在不同溶剂中溶解度的不同,达到析出晶体的目的;
(5)硫酸钙难以除去,可加入碳酸钠转化为碳酸钙,加入盐酸和除去.
解答 解:(1)碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2,
故答案为:2CaCO3+2SO2+O2═2CaSO4+2CO2;
(2)氨水过量才生成(NH4)2SO3•H2O,若氨水不足则生成NH4HSO3,(NH4)2SO3•H2O中硫元素化合价+4价,易被氧化生成SO42-,在含有SO32-的溶液中检验SO42-,先加过量BaCl2溶液,再加入过量的盐酸,弱生成白色沉淀部分溶解说明溶液中含有SO42-,
故答案为:过量;稀盐酸、BaCl2溶液;
(3)反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,温度过高NH4HCO3分解,反应Ⅳ温度不能过高的原因是防止温度过高NH4HCO3分解,
故答案为:1:4;防止温度过高NH4HCO3分解;
(4)反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,反应的化学方程式为:(NH4)2SO4+2KCl=K2SO4↓+2NH4Cl,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;(NH4)2SO4+2KCl=K2SO4↓+2NH4Cl;
(5)CaSO4是一种微溶物,20℃时其溶解度为0.272,若溶液的密度为1.00g•cm-3,计算硫酸钙饱和溶液中的物质的量浓度,c=$\frac{1000×1.00×\frac{0.272}{100+0.272}}{136}$mol/L,则此温度下CaSO4的溶度积常数Ksp=c(Ca2+)c(SO42-)=($\frac{1000×1.00×\frac{0.272}{100+0.272}}{136}$mol)2=4.0×10-4,
由Ksp数据可知,碳酸钙更难溶,则清洗CaSO4的过程为CaSO4在水中存在平衡CaSO4(s)?Ca2+(aq)+SO42-(aq),用Na2CO3溶液浸泡后,Ca2+与CO32-结合成更难溶的CaCO3,使上述平衡右移,CaSO4转化成CaCO3,然后用盐酸除去,所以锅炉水垢中的CaSO4常用Na2CO3浓溶液和稀盐酸先后浸泡除去,
故答案为:4.0×10-4;由Ksp数据可知,碳酸钙更难溶,则清洗CaSO4的过程为CaSO4在水中存在平衡CaSO4(s)?Ca2+(aq)+SO42-(aq),用Na2CO3溶液浸泡后,Ca2+与CO32-结合成更难溶的CaCO3,使上述平衡右移,CaSO4转化成CaCO3,然后用盐酸除去.
点评 本题考查了物质分离提纯、物质性质、物质制备实验方案分析、溶度积常数计算等知识点,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
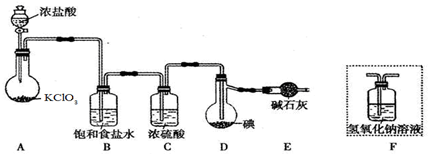
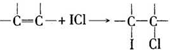
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的能量一定高于N | |
| B. | X、Y的能量总和高于M、N的能量总和 | |
| C. | 因为该反应为放热反应,故不必加热就可发生 | |
| D. | 断裂X、Y的化学键所吸收的能量高于形成M、N的化学键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
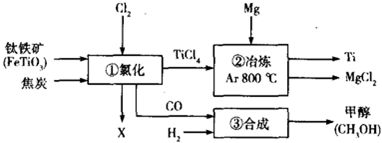
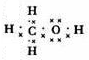 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | 将SO2通入品红溶液中,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com