
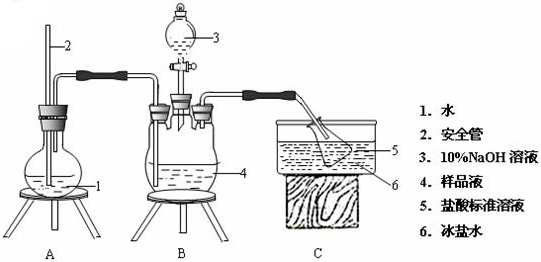
分析 【制备】
(1)冰饱和食盐水温度低,固体溶解度小,用冰饱和食盐水洗涤晶体,减小晶体溶解,双氧水受热易分解,液氨易挥发;
【测定组成】
(2)安全管的作用是平衡气压,使烧瓶内外压强平衡;
(3)用氢氧化钠标准溶液滴定过量的氯化氢,碱式滴定管需用标准液润洗,滴定管0刻度在滴定管的上方;A.装置气密性不好,部分氨气逸出; B.强酸强碱滴定,用酚酞作指示剂无影响;C.滴定终点时俯视读数,读数小于实际体积; D.滴定时NaOH溶液外溅,标准液NaOH溶液计算体积偏大,导致测得剩余盐酸体积偏大;
(4)硝酸银易分解,类似浓硝酸,硝酸银在光照的条件下易分解,生成银、二氧化氮和氧气,根据Ksp(Ag2CrO4)=c2(Ag+)•c(CrO42-)计算;
(5)根据Ag++Cl-=AgCl(s),样品M中氯元素质量等于氯离子的质量,据此计算样品M中氯元素质量分数;根据铬酸银、氯化银的溶度积知,铬酸银的溶解度比氯化银稍大一些.如果滴加铬酸钾溶液过多,会提前生成铬酸银,即氯离子没有完全转化成氯化银,导致提前指示终点,测得氯元素质量分数偏低;
(6)晶体M中铬、氨和氯的质量之比为104:136:213.计算出三种元素的物质的量之比,求出M的化学式,根据化学式书写方程式.
解答 解:【制备】
(1)晶体析出后过滤得到晶体,用冰饱和食盐水洗涤晶体,目的是减少晶体M溶解量,双氧水受热易分解2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑,液氨易挥发,加热温度过高,导致反应物损失,
故答案为:降低晶体溶解度;加快双氧水分解和液氨挥发;
【测定组成】
(2)A装置用于提供水蒸汽,需要加热.导管起平衡气压作用,故答案为:平衡气压;
(3)滴定管经检漏之后,用标准氢氧化钠溶液润洗、滴定管0刻度在上方,需调节液面至0刻度及0刻度以下才可读数,
A.装置漏气,部分氨气扩散了,测定的NH3质量分数偏低,故A错误;
B.强碱滴定强酸可以选择甲基橙作或酚酞作指示剂,不会导致误差,故B错误;
C.滴定终点时俯视读数,读数小于实际体积,测定消耗氢氧化钠溶液体积偏小,NH3质量分数偏高,故C正确;
D.滴定液外溅,导致测得剩余盐酸体积偏大,NH3质量分数偏小,故D错误;
故答案为:用标准NaOH溶液润洗;调节碱式滴定管内液面至0刻度或0刻度以下;C;
(4)硝酸银很不稳定,在光照的条件下易分解:2AgNO3$\frac{\underline{\;光照\;}}{\;}$2NO2↑+O2↑+2Ag,应选择棕色滴定管盛装硝酸银溶液,Ksp(Ag2CrO4)=c2(Ag+)•c(CrO42-),c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{1.12×1{0}^{-12}}{2.8×1{0}^{-3}}}$mol•L-1=2.0×10-5mol•L-1,
故答案为:2.0×10-5mol•L-1;
(5)Ag++Cl-=AgCl(s),ω(Cl)=$\frac{cmol/L×\frac{b}{1000}L×35.5g/mol}{ag×\frac{25.00ml}{100ml}}$,铬酸银Ksp(Ag2CrO4)=1.12×10-12,氯化银Ksp(AgCl)=1.8×10-10,铬酸银的溶解度比氯化银稍大一些.如果滴加铬酸钾溶液过多,会提前生成铬酸银,即氯离子没有完全转化成氯化银,导致提前指示终点,测得氯元素质量分数偏低,
故答案为:$\frac{cmol/L×\frac{b}{1000}L×35.5g/mol}{ag×\frac{25.00ml}{100ml}}$;偏低;
(6)n(Cr):n(NH3):n(Cl)=$\frac{104}{52}$:$\frac{136}{17}$:$\frac{213}{35.5}$=1:4:3,M的化学式为Cr(NH3)4Cl3.M中铬元素化合价为+3,化学方程式为2CrCl2+H2O2+6NH3+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$2Cr(NH3)4Cl3+2H2O,
故答案为:2CrCl2+H2O2+6NH3+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$2Cr(NH3)4Cl3+2H2O.
点评 本题考查了定量实验方案的设计,考查了物质的制备实验操作、组成的测定、沉淀溶解平衡等,明确每一过程发生的反应是解本题关键,侧重于基础知识的综合应用的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
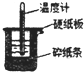 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4 g乙烯与丙烯的混合气体含有NA个碳原子 | |
| B. | 精炼铜,若阳极失去2NA个电子,则阴极增重64 g | |
| C. | 在1 L 0.1mol/L 的Na2CO3溶液中,阴离子总数小于0.1NA | |
| D. | 将1 L 2 mol/L 的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、SO42-、CO32-、K+ | B. | Na+、Ba2+、Ca2+、HCO3- | ||
| C. | Mg2+、Ag+、K+、Cl- | D. | K+、Cl-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+H2O(g)═CO2+H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com