
【题目】工业上氟气可作为火箭燃料中的氧化剂。1886年法国化学家![]() 通过电解氟氢化钾
通过电解氟氢化钾![]() 的氟化氢无水溶液第一次制得氟气。已知:
的氟化氢无水溶液第一次制得氟气。已知:![]() ,制备氟气的电解装置如下图所示。下列说法错误的是( )
,制备氟气的电解装置如下图所示。下列说法错误的是( )

A. 钢电极与电源的负极相连
B. 氟氢化钾在氟化氢中可以电离
C. 阴极室与阳极室必须隔开
D. 电解过程需不断补充的X是KF。
【答案】D
【解析】
根据图示,碳电极上F-失去电子生成F2,发生氧化反应,碳电极为阳极,则钢电极为阴极,电极反应式为2HF2-+2e-═H2+4F-,据此分析解答。
A. 根据上述分析,钢电极为阴极,与电源的负极相连,故A正确;
B. 根据题意“电解氟氢化钾![]() 的氟化氢无水溶液制得氟气”,说明氟氢化钾
的氟化氢无水溶液制得氟气”,说明氟氢化钾![]() 的氟化氢无水溶液能够导电,即氟氢化钾在氟化氢中可以电离,故B正确;
的氟化氢无水溶液能够导电,即氟氢化钾在氟化氢中可以电离,故B正确;
C. 阴极室生成的氢气与阳极室生成的氟气能够发生剧烈的化合反应,必须隔开,故C正确;
D.钢电极为阴极,碳电极为阳极,阳极生成气体为氟气,阴极放出氢气,随着电解的进行,H和F元素不断消耗,电解过程需不断补充的X是HF,故D错误;
答案选D。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.从海水中提取溴,只需经过物理变化就可以得到溴单质
B.目前工业上直接由海水提取I2
C.海水蒸发制海盐的过程中发生了化学变化
D.从海水中可以得到NaCl,电解熔融NaCl可制备Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如图:
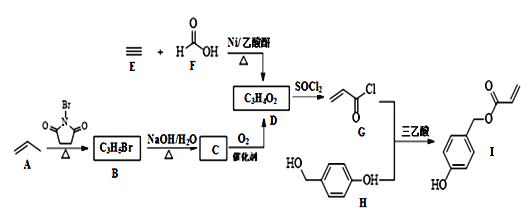
回答下列问题:
(1)I中含氧官能团的名称为____。
(2)由B生成C的化学方程式为__。
(3)由E和F反应生成D的反应类型为____,由G和H反应生成I的反应类型为____。
(4)仅以D为单体合成高分子化合物的化学方程式为___。
(5)X是I的芳香同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。写出两种符合要求的X的结构简式___。
(6)参照本题信息,试写出以1丁烯为原料制取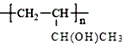 的合成路线流程图(无机原料任选)___。
的合成路线流程图(无机原料任选)___。
合成路线流程图示例如图:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含S2﹣、Fe2+、Br﹣、I﹣各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是( )
A.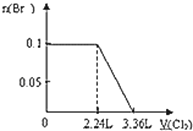 B.
B.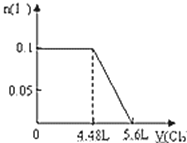
C.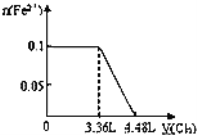 D.
D.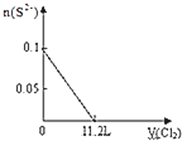
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 常温常压下,11.2L二氧化碳含有的原子数等于1.5NA
B. 100mL1mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,22.4LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为2NA
D. 常温常压下,48gO2与O3混合物含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)
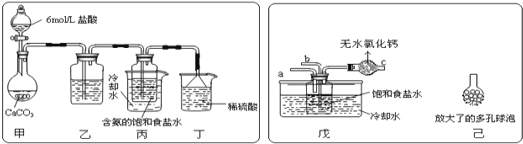
(1)丁装置中稀硫酸的作用是____。
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从___管通入NH3气体。
(3)有同学建议在戊装置的b管下端连接己装置,理由是_____。
(4)如表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水):
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:____。
(5)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为ag。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:
![]()
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是___(填字母)。
a 在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b 在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c 在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。
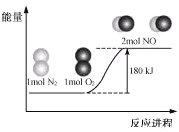
下列说法正确的是
A. N2(g)+O2(g)=2NO(g) △H=-180![]()
B. NO(g)=1/2N2(g)+1/2O2(g) △H=+90![]()
C. 断开1mol NO(g)中化学键需要吸收632kJ能量
D. 形成1 mol NO(g)中化学键可释放90kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO![]() 、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是____和______。
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体(无气体生成),则C为___。(填名称)
(3)将38.4g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D为_________(化学式),写出Cu溶解的离子方程式_______,若要将Cu完全溶解,至少加入H2SO4的物质的量是_________。
(4)足量E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知D溶液为黄色,E溶液为无色.请回答:
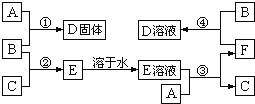
(1)B是_____,F是_____(请填写化学式);
(2)反应③的离子方程式_____;
(3)反应④的离子方程式_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com