
【题目】实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该反应的氧化剂是_____________,氧化产物是_____________,用双线桥或单线桥法表示上述反应电子转移的方向和数目____________________________________。
(2)计算当有73.0克HCl被氧化时,消耗MnO2的质量为_____________。
(3)在反应MnO2+4HCI![]() MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是____________。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是____________。
【答案】 MnO2 Cl2 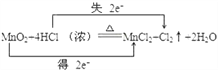 87g 2.24L
87g 2.24L
【解析】(1)Mn元素化合价从+4价降低到+2价,得到电子,因此该反应的氧化剂是MnO2,Cl元素化合价从-1价升高到0价,失去电子,氯化氢是还原剂,所以氧化产物是Cl2,根据电子得失守恒可知用双线桥表示该反应电子转移的方向和数目为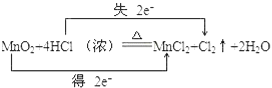 ;(2)73.0克HCl的物质的量是73g÷36.5g/mol=2mol,失去2mol电子,所以根据电子得失守恒可知消耗MnO2的物质的量是2mol÷2=1mol,质量为1mol×87g/mol=87g。(3)产生1mol氯气转移2mol电子,当有0.2mol电子转移时,产生氯气的物质的量是0.1mol,在标准状况下的体积是2.24L。
;(2)73.0克HCl的物质的量是73g÷36.5g/mol=2mol,失去2mol电子,所以根据电子得失守恒可知消耗MnO2的物质的量是2mol÷2=1mol,质量为1mol×87g/mol=87g。(3)产生1mol氯气转移2mol电子,当有0.2mol电子转移时,产生氯气的物质的量是0.1mol,在标准状况下的体积是2.24L。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】 如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )

A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色
B.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀,后沉淀又溶解
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A、1molH2SO4与1mol Ba(OH)2完全中和所放出的热量为中和热
B、中和反应都是放热反应,盐类水解反应都是吸热反应
C、在101kPa1mol碳燃烧所放出的热量一定是碳的燃烧热
D、碳与二氧化碳的反应既是吸热反应,也是化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式:S(l)+O2(g)![]() SO2(g) ΔH=-293.23 kJ·mol-1 ,分析下列说法中正确的是
SO2(g) ΔH=-293.23 kJ·mol-1 ,分析下列说法中正确的是
A.S(s)+O2(g)![]() SO2(g),反应放出的热量大于293.23 kJ·mol-1
SO2(g),反应放出的热量大于293.23 kJ·mol-1
B.S(g)+O2(g)![]() SO2(g),反应放出的热量小于293.23 kJ·mol-1
SO2(g),反应放出的热量小于293.23 kJ·mol-1
C.1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和
D.1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH![]() +2H2O===NH3·H2O+H3O+
+2H2O===NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O===2AlO![]() +3H2↑
+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
 +2HCO
+2HCO![]() →
→ +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO![]() +16H++5C2O
+16H++5C2O![]() ===2Mn2++10CO2↑+8H2O
===2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用18mol/L的浓硫酸配制100mL 0.9mol/L的稀硫酸,根据这种溶液的配制回答下列问题:
(1)量取该实验中的浓硫酸所用的量筒的规格是______(填序号)。
A.10mL B.20mL C.50mL D.100mL
(2)本实验用到的基本仪器有玻璃棒、量筒、烧杯,还需要的玻璃仪器有________。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为______(填序号)。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏高”、“偏低”、“无影响”填写)
A.容量瓶中原来有少量蒸馏水_______;
B.往容量瓶转移溶液时有少量的液体溅出_______;
C.定容时俯视刻度线_______;
D.定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们欲寻找一种新型的半导体材料, 可以在元素周期表的
A. 任意位置寻找 B. 稀有气体元素中寻找
C. 金属和非金属的分界线处寻找 D. 活泼金属和活泼非金属区中寻找
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3晶体是一种常见的氧化剂,生产工艺如图所示:

请回答下列问题:
(1)CaCO3煅烧前要粉碎的目的是____________________________。
(2)写出“氯化池”中生成Ca(ClO3)2的化学方程式:___________________________。该反应中,氧化剂与还原剂的物质的量之比为________。
(3)操作a中所需的玻璃仪器有漏斗、烧杯、__________。
(4)实验室制取KClO3可通过反应:3Cl2+6KOH![]() 5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)
5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)

(5)甲同学为测定制取的KClO3样品中ClO3的含量,称取样品a g,准确配制成1000 mL溶液,从上述溶液中取出10.00 mL于锥形瓶中,准确加入30.00 mL 1.00 mol·L1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100 mL蒸馏水及某种氧化还原反应指示剂,用0.200 mol·L1 K2Cr2O7标准溶液滴定至终点,消耗5.00 mL。样品中ClO3的质量分数为______________。(已知:Cr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O,ClO3可被Fe2+还原为Cl。)
2Cr3++6Fe3++7H2O,ClO3可被Fe2+还原为Cl。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com