
| A. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| B. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| C. | 用溶解、过滤的方法分离K2MnO4和MnO2固体的混合物 | |
| D. | 用分液的方法分离煤油和汽油 |
分析 A.丁达尔现象为胶体特有的性质;
B.氢气还原CuO生成Cu,Cu可被氧气氧化;
C.二者中只有MnO2不溶于水;
D.煤油和汽油互溶.
解答 解:A.丁达尔现象为胶体特有的性质,则丁达尔效应可鉴别Fe(OH)3胶体和FeCl3溶液,故A正确;
B.氢气还原CuO生成Cu,Cu可被氧气氧化,则不能通过灼热的氧化铜除杂,故B错误;
C.二者中只有MnO2不溶于水,则用溶解、过滤的方法可分离,故C正确;
D.煤油和汽油互溶,不能分液,应选蒸馏法,故D错误;
故选AC.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用及实验评价性分析,题目难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 向容量瓶中加水未到刻度线 | |
| B. | 所用NaOH已经潮解 | |
| C. | 有少量NaOH溶液残留在烧杯里 | |
| D. | 用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | 加碘食盐中所加的“碘”一般是碘化钾或碘单质 | |
| C. | 区别氯化铁溶液和氢氧化铁胶体可以用丁达尔效应 | |
| D. | 用干燥的有色布条可以检验氯化氢气体中是否混有氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫元素的质量比为5:4 | B. | 任何情况下体积比均为1:1 | ||
| C. | 含有的O2、O3两分子数之比为1:1 | D. | SO2、SO3两分子数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
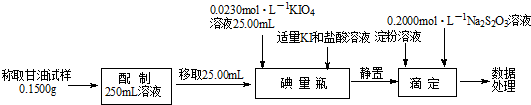
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
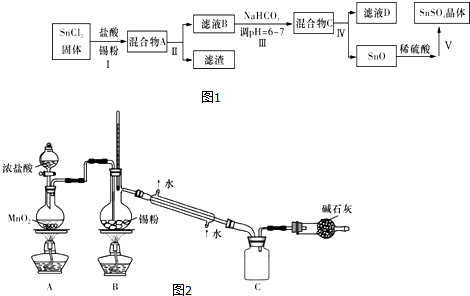
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )
某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )| A. | 2min内,X的平均反应速率为0.25mol/(L•min) | |
| B. | 第5min时,该反应达到平衡状态 | |
| C. | 第5min后,Y的生成速率与X的消耗速率相等且保持不变 | |
| D. | 5min内,反应放出的热量为1.6QkJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com