
下列有关物质的性质与应用不对应的是
A.氨气具有还原性,可用作制冷剂
B.MgO、Al2O3熔点高,可用于制作耐火材料
C.Na2CO3溶液显碱性,可用其热溶液除去金属餐具表面油污
D.常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸
科目:高中化学 来源: 题型:
有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯 ②乙烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色 ④乙烯使酸性高锰酸钾溶液褪色 ⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应 ⑦溴乙烷和氢氧化钠乙醇溶液共热⑧溴乙烷和氢氧化钠溶液共热
其中属于取代反应的是 ;属于氧化反应的是.________;属于加成反应的是.________;属消去反应的是 ;属于聚合反应的是_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液
B.催化剂可以加快化学反应速率但不能改变化学反应的焓变
C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱
D.对于反应2SO2(g)+O2(g) 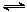 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)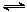 CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)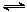 CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)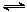 CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)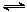 CH3OCH3(g)+CO2(g)的△H= ▲ kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= ▲ kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 ▲ 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 ▲ 。
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) 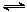 CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 ▲ 。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 ▲ 。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%[
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 ▲ 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 ▲ 。
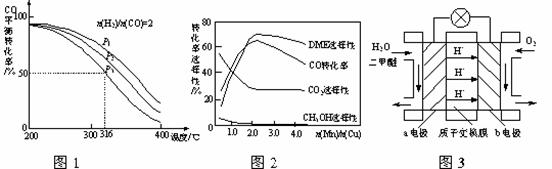
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:

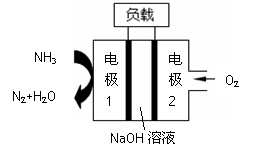
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电
池示意图如右,有关说法正确的是
A.电池工作时,Na+ 向负极移动
B.电子由电极2经外电路流向电极1
C.电池总反应为:4NH3+3O2=2N2+6H2O
D.电极2发生的电极反应为:O2+ 4H + + 4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCl2常用于冬季道路除雪,建筑工业的防冻等,实验室常用作干燥剂。工业上常用大理石(含有少量Al3+、Fe2+、Fe3+等杂质)来制备。下图为实验室模拟其工艺流程:


已知:常温下,溶液中的Fe3+、Al3+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,4,9.7。
(1)反应Ⅰ中,需将大理石粉碎、搅拌,同时适当加热,其目的是: ▲ 。
写出反应Ⅰ中主要反应的离子方程式: ▲ 。
(2)上述使用盐酸的浓度为10%,若用37%的浓盐酸来配制500mL的此盐酸所需的玻璃仪器有:玻璃杯、量筒、烧杯、胶头滴管、 ▲ 。
(3)反应Ⅱ中的离子方程式: ▲ 。
(4)反应Ⅲ中必须控制加入Ca(OH)2的量,使溶液的pH约为8.0,此时沉淀a的成分为:
▲ ,若pH过大,则可能发生副反应的离子方程式: ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列微粒半径大小比较正确的是:
A.Na+<Mg2+<Al3+<O2- B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S D.Ca<Rb<K<Na
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol,
则甲烷的燃烧热为Q kJ/mol
B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的
ΔH<0
C.反应N2(g)+3H2(g) 2NH3(g)ΔH<0达到平衡后,升高温度,反
2NH3(g)ΔH<0达到平衡后,升高温度,反
应速率v(H2)和H2的平衡转化率均增大
D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值
均大于零):
H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol
H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com