
| A、反应后溶液呈碱性,且溶液中OH-的物质的量为1mol |
| B、反应后,铝元素的存在形式有Al(OH)3和AlO2-,且物质的量分别为1mol、0.5mol |
| C、反应后溶液中有K2SO4和KAlO2两种溶质 |
| D、反应中生产沉淀Al(OH)3和BaSO4的物质的量分别为2mol、3.5mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、4.00g | B、3.43g |
| C、4.50g | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有1.6g H2O生成 |
| B、有8.4g Cu生成 |
| C、有80%的CuO被还原 |
| D、实验过程中所消耗的氢气为0.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
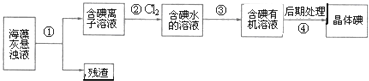
| A、可用淀粉溶液检验步骤②的反应是否进行完全 |
| B、步骤③中加入的有机溶剂是乙醇 |
| C、步骤④的操作是过滤 |
| D、步骤①、③的操作分别是过滤、萃取分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com