
根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是( )
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)电解它们的熔融氯化物,阴极放电反应最可能正确的是( )
A.Q2++2e-→Q B.R2++2e-→R
C.S3++3e-→S D.T3++3e-→T E.U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是( )
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(4)S元素最可能是( )
A.S区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1)D.氢(1s1) E.氦(1s2)
请把答案填在下表:
1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
科目:高中化学 来源: 题型:
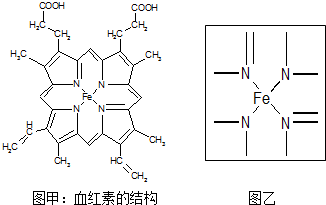


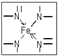

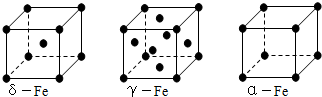
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
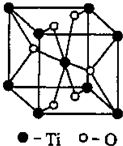 [化学-物质结构与性质]
[化学-物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
| … | A | ||||||
| B | C | D |
查看答案和解析>>
科目:高中化学 来源:同步题 题型:不定项选择题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com