
| A. | 除去MgCl2溶液中少量的FeCl3:加入足量的Mg(OH)2并过滤 | |
| B. | 除去NaCl溶液中少量的Na2S:加入AgCl后再过滤 | |
| C. | 除去石英中的少量碳酸钙:用稀盐酸溶解后过滤 | |
| D. | 除去氯化钠固体中的少量纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
分析 A.FeCl3易水解生成氢氧化铁;
B.加入AgCl,易转化生成溶解度更小的Ag2S沉淀;
C.碳酸钙与盐酸反应生成氯化钙;
D.如氯化钙过量,引入新杂质.
解答 解:A.FeCl3易水解生成氢氧化铁,加入Mg(OH)2粉末,调节溶液的pH,促进铁离子的水解,且不引入新的杂质,故A正确;
B.加入AgCl,易转化生成溶解度更小的Ag2S沉淀,可除去杂质,故B正确;
C.二氧化硅与盐酸不反应,碳酸钙与盐酸反应生成氯化钙,可用于除杂,故C正确;
D.如氯化钙过量,引入新杂质,应加入适量,故D错误.
故选D.
点评 本题考查物质的分离、提纯,为高频考点,题目侧重学生的分析能力和实验能力的考查,从难溶电解质的溶解平衡的角度沉淀的转化,难度不大,注意把握物质的性质.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
 常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( )
常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( )| A. | 酸B比酸A的电离度大 | B. | A为弱酸,B为强酸 | ||
| C. | 酸B的物质的量浓度比A的小 | D. | A酸比B酸易电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶液在电流作用下电离成K+和Cl- | |
| B. | 氧化还原反应的本质是有化合价的升降 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 碱性氧化物均属于金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═2H++SO42- | B. | NH4NO3═NH4++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.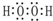 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B | B. | A=10-4B | C. | B=10-4A | D. | A=B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com