
| A. | 物理 | B. | 化学 | C. | 地理 | D. | 生物 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24LC2H4和C2H2的混合气体中含碳原子数目小于0.2NA | |
| B. | 100mL1.0mol/L的FeCl3溶液与足量Cu反应,转移电子数数为0.2NA | |
| C. | 标况下44.8mL氯气通入足量水中发生反应,转移电子数为2×10-3NA | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2、Al(OH)3 | B. | Al(OH)3、NaHCO3 | C. | Na2SO3、Mg(OH)2 | D. | Na2CO3、CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | .原溶液的c(H+)=0.08mol/L | B. | 原溶液中n(Mg2+):n(Al3+)=10:1 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.066mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同位素1H的相对原子质量 | |
| B. | 氢元素的平均相对原子质量 | |
| C. | 氢元素各同位素质量数与百分含量算出的平均值 | |
| D. | 同位素2H的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中新月形分子和环状分子“组合”在一起,铜离子起关键作用 | |
| B. | 利用此方式可以合成新分子,同时也可能创造一种全新“机械键” | |
| C. | 在创造新分子技术中,铜离子是唯一可以借助的金属离子 | |
| D. | 此技术可以“互锁”合成 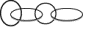 分子,甚至成更复杂的分子 分子,甚至成更复杂的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
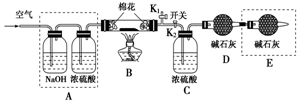 为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x
为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3)(5) | B. | (1)(3)(5) | C. | (2)(3)(6) | D. | (1)(3)(4)(5) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com