
 如图是一个电化学过程示意图.
如图是一个电化学过程示意图. 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 压缩容器体积,增大压强,活化分子百分数不变,化学反应速率增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率增大 | |
| C. | 加入反应物,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应所需的活化能,活化分子百分数增大,化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应原理 | 实验装置 | 实验步骤 |
(1)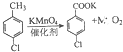 (2) 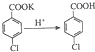 | 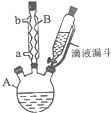 | ①在规格为250mL的仪器A中加入一定量的催化剂(易溶于有机溶剂)、适量KMnO4、100mL水; ②安装好仪器,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯; ③控制温度在93℃左右,反应2h,趁热过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩,冷却; ④再次过滤,将滤渣用冷水进行洗涤,干燥后称得其质量为7.19g |
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 属于可溶性盐 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
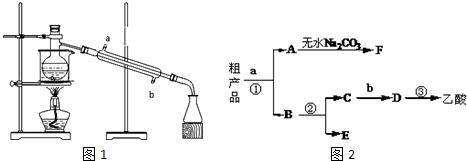
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | 碱金属元素是指ⅠA族的所有元素 | |
| D. | 副族元素中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质的分子式为C3H8O | |
| B. | 分子中共有6种化学环境不同的氢原子 | |
| C. | 该有机物的结构简式为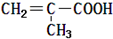 | |
| D. | 该有机物可能与新制的氢氧化铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
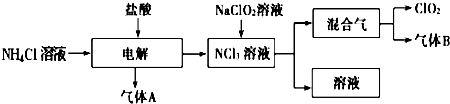
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用图中的实验装置制取乙炔.
用图中的实验装置制取乙炔. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置除去乙酸乙酯中混有的少量乙酸 | |
| B. |  用装置除去氯气中的少量氯化氢 | |
| C. | 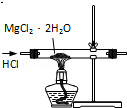 用装置制取无水MgCl2 | |
| D. |  用装置制取乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com