
|
工业上由SiCl4制备高纯硅时,不使用钠、镁等活泼金属做还原剂,而是用氢气作还原剂其原因是 | |
| [ ] | |
A. |
钠或镁等活泼金属的价格昂贵,成本高 |
B. |
钠或镁等活泼金属的还原性不及氢气强 |
C. |
钠或镁等金属可能与硅形成合金或残留在硅中 |
D. |
钠或镁的熔点没有硅高 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为____________。
(2)工业上可通过如下流程由粗硅制取纯硅:
Si(粗)![]() SiCl4(l)
SiCl4(l) ![]() Si(纯)
Si(纯)
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产100.8 t纯硅需纯度为75%的石英砂多少吨?
(3)工业上还可以通过下图所示的流程来制取纯硅:

反应①:Si(粗)+3HCl(g) ![]() SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)
反应②:SiHCl3+H2![]() Si(纯)+3HCl
Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%,则在下轮次的生产中,需补充投入HCl和H2的体积比为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产粗硅的主要原理为:SiO2+2C 3273K Si(粗)+2CO↑。
(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为 ?? 。
(2)工业上可通过如下流程由粗硅制取纯硅:
| ||||||
|
| |||||
![]()
![]()
![]() Si(粗) SiCl4(l) Si(纯)
Si(粗) SiCl4(l) Si(纯)
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产100.8t纯硅需纯度为75%的石英砂多少吨?
(3)工业上还可以通过下图所示的流程来制取纯硅:
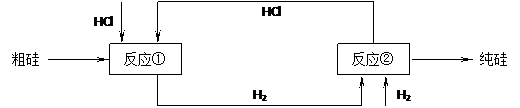
反应①: Si(粗)+3HCl(g) 553~573K SiHCl3(l)+H2(g)
反应②: SiHCl3+H2 1373K Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%,则在下轮次的生产中,需补充投入HCl和H2的体积比为多少?
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题


查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com