
【题目】控制适合的条件,将反应Fe3++AgFe2++Ag+设计成如下图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后,观察到电流计指针向右偏转。下列判断不正确的是( )。
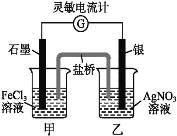
A. 在外电路中,电子从银电极流向石墨电极
B. 盐桥中的K+移向甲烧杯
C. 电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
D. 一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
【答案】D
【解析】
根据原电池总反应方程式Fe3++Ag![]() Fe2++Ag+可知石墨电极为正极,Fe3+得电子,发生还原反应,银电极为负极,Ag失电子,发生氧化反应,据此解答。
Fe2++Ag+可知石墨电极为正极,Fe3+得电子,发生还原反应,银电极为负极,Ag失电子,发生氧化反应,据此解答。
A项,石墨电极为正极,得到电子,银电极为负极,失去电子,因此外电路中电子从银电极流向石墨电极,故A项正确。
B项,盐桥中的阳离子K+移向正极处的FeCl3溶液,以保证两电解质溶液均保持电中性,故B项正确;
C项,电流计指针居中后,往甲烧杯中加入一定量的铁粉,由于铁的金属活动性比银强,形成了新的原电池,此时铁作负极,银电极作正极,外电路电流方向为由由银到石墨,故电流计指针将向左偏转,故C项正确;
D项,一段时间后,原电池反应结束,灵敏电流计指针应该指向0刻度,故D项错误;
综上所述,本题正确答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和H。已知A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。H是一种比水轻的油状液体,H仅由碳氢两种元素组成,H不能使酸性KMnO4溶液褪色,其碳元素与氢元素的质量比为12:1,H的相对分子质量为78。下列是有机物A~G之间的转化关系:
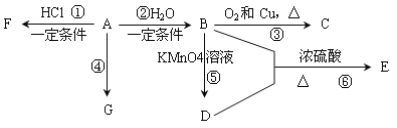
请回答下列问题:
(1)E中所含官能团的名称是___________________________;
(2)写出反应③的化学方程式_____________________________________________;
(3)G是一种高分子化合物,可以用来制造多种包装材料和农用薄膜材料等,其结构简式是______________________;
(4)在体育竞技比赛中,当运动员肌肉挫伤或扭伤时,随队医生立即对准其受伤部位喷射物质F(沸点12.27℃)进行应急处理。写出由A制备F的化学方程式:_______________;
(5)等质量的A、H完全燃烧时消耗O2的物质的量_______(填“A>H、A<H或A=H”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应2SO2+O2![]() 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①②B. ①③C. ①D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下可逆反应:Fe2(SO4)3+6KSCN![]() 2Fe(SCN)3+3K2SO4达到平衡状态后加入少量下列何种固体物质,该平衡几乎不发生移动( )
2Fe(SCN)3+3K2SO4达到平衡状态后加入少量下列何种固体物质,该平衡几乎不发生移动( )
A. NH4SCN B. K2SO4 C. NaOH D. FeCl3·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点。已知铊有两种天然同位素![]() 和
和![]() 。下列关于
。下列关于![]() 说法正确的是( )
说法正确的是( )
A. 中子数与质子数之差为122B. 中子数与电子数之差为122
C. 质量数与中子数之差为81D. 质量数与电子数之差为81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式__________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为____。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
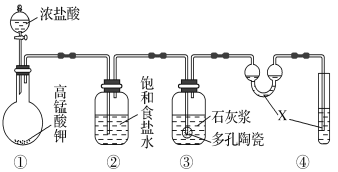
(1)装置④中的X试剂为_____________________。
(2)装置③中发生反应的化学方程式为_______________________,
(3)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,利用如图所示装置探究元素非金属性强弱的变化规律。
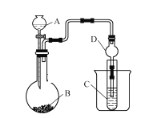
(1)仪器A的名称为_________,干燥管D的作用是_____。
(2)实验室中现有药品Na2S、浓盐酸、稀硫酸、MnO2,请选择合适药品设计实验探究氯和硫的非金属性强弱(必要时可以加热,图中省略):
①装置A中所装药品为_________。
②装置C中的实验现象为:有淡黄色沉淀生成,该装置中的化学反应方程式为__________。
③根据该实验探究出的结果,可知HCl的稳定性比H2S的稳定性____。(填“强”或“弱”)
(3)若要探究硫和碳元素的非金属性强弱,B、C中所装药品分别为Na2CO3固体、澄清石灰水,则A中反应的离子方程式为__________,观察到C装置中的现象为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出实验中发生反应的离子方程式:___________,该反应是_____反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花____ s。
(3)对比结果B与F,解释结果F那么快的原因:________
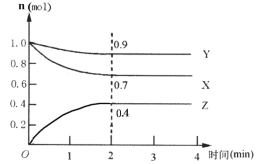
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
(1)该反应的的化学方程式为_______;
(2)反应开始至2分钟时,X的平均反应速率为______;
(3)能说明该反应已达到平衡状态的是______;
a.每消耗3molX,同时消耗1molY
b.容器内压强保持不变
c.Z的浓度不再变化
d.容器内混合气体的密度保持不变
(4)由下图求得平衡时Y的转化率为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com