
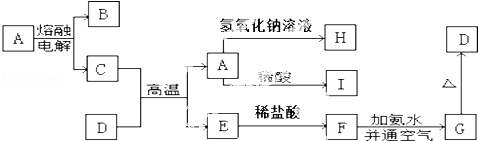
分析 D是一种红棕色固体,则可知,为Fe2O3;又A即可与强碱反应又可与强酸反应,是高熔点固体,则为Al2O3,C+D→A+E为铝热反应,E为Fe,C为Al,Al2O3电解时生成Al和O2,则B为O2,氧化铝与氢氧化钠反应生成H为NaAlO2,氧化铝与盐酸反应生成I为AlCl3,铁与盐酸反应生成F为FeCl2,氯化亚铁中加入氨水,生成氢氧化亚铁,在空气中被空气氧化得G为Fe(OH)3,结合物质的性质和题目要求可解答该题.
解答 解:D是一种红棕色固体,则可知,为Fe2O3;又A即可与强碱反应又可与强酸反应,是高熔点固体,则为Al2O3,C+D→A+E为铝热反应,E为Fe,C为Al,Al2O3电解时生成Al和O2,则B为O2,氧化铝与氢氧化钠反应生成H为NaAlO2,氧化铝与盐酸反应生成I为AlCl3,铁与盐酸反应生成F为FeCl2,氯化亚铁中加入氢氧化钠,在空气中被空气氧化得G为Fe(OH)3,
(1)根据上面的分析可知,A为Al2O3,B为O2,D为Fe2O3,H为NaAlO2,
故答案为:Al2O3;O2;Fe2O3;NaAlO2;
(2)①C+D→A+E的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
②A→H为氧化铝与氢氧化钠的反应,离子方程式为Al2O3+2OH-=2AlO2-+H20,
③F→G为氯化亚铁中加入氨水,生成氢氧化亚铁,氢氧化亚铁在空气中被空气氧化得G为Fe(OH)3,反应的化学方程式为:FeCl2+2NH3•H2O=Fe(OH)2↓+2NH4Cl、4Fe(OH)2+O2+2H2O=4Fe(OH)3↓,
故答案为:①Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;②Al2O3+2OH-=2AlO2-+H20;③FeCl2+2NH3•H2O=Fe(OH)2↓+2NH4Cl、4Fe(OH)2+O2+2H2O=4Fe(OH)3↓;
(3)氯化亚铁中加入氢氧化钠,在空气中被空气氧化得G为Fe(OH)3,现象为有白色沉淀生成,迅速变灰绿色,最后变红褐色,故答案为:有白色沉淀生成,迅速变灰绿色,最后变红褐色.
点评 本题考查无机框图推断,为高考常见题型,题目难度中等,本题不仅考查对元素化合物基础知识的掌握,还主要考查学科内知识间的综合推理能力,答题时注意根据物质的颜色和反应的条件进行推断.


科目:高中化学 来源: 题型:选择题
| A. | 微粒半径由小到大的顺序是S2-、Na+、Mg2+ | |
| B. | 杂化轨道可用于形成σ键和π键 | |
| C. | Cu(NH3)4]2+中H提供接受孤对电子的空轨道 | |
| D. | 分子中心原子通过sp3杂化轨道成键时,该分子不一定为四面体构型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纳米碳(粒子直径为1~100nm的材料)均匀地分散到蒸馏水中,所形成的体系是胶体 | |
| B. | 氢氧化铁胶体带正电,所以进行电泳实验时,阴极区域颜色加深 | |
| C. | 可以用丁达尔效应区分氢氧化铁胶体和碘水 | |
| D. | 明矾和硫酸铁的净水原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个二氧化碳分子 | B. | 含有1molO2 | ||
| C. | 质量为44 g•mol-1 | D. | 所占的体积为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com