
【题目】下列说法不正确的是
A.1 mol 冰中拥有2 mol氢键
B.分子晶体中既有范德华力,又有共价键
C.干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个
D.晶体熔点:晶体硅<SiC
【答案】B
【解析】
A.每个水分子形成4个氢键,每个氢键为2个水分子共用,平均每个水分子形成2个氢键,则1 mol 冰中拥有2 mol氢键,A正确;
B.大多数分子晶体中既有范德华力,又有共价键,稀有气体的晶体是由原子通过分子间作用力构成得到分子晶体,故稀有气体的晶体中只有范德华力,B错误;
C.干冰晶胞如图, CO2分子分布在晶胞的八个顶点和六个面心上,所以每个CO2分子周围距离(即小立方体的面对角线长度)相等且最近的CO2分子共有12个,C正确;
CO2分子分布在晶胞的八个顶点和六个面心上,所以每个CO2分子周围距离(即小立方体的面对角线长度)相等且最近的CO2分子共有12个,C正确;
D.晶体硅、SiC属于原子晶体,熔化需要破坏共价键,共价键越牢固原子晶体熔点越高,晶体硅中Si- Si不如碳化硅中Si-C键牢固,因此晶体熔点:晶体硅<SiC,D正确;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
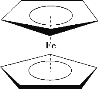
A.二茂铁属于分子晶体
B.环戊二烯中碳原子的杂化方式有sp3和sp2
C.1mol 环戊二烯( ![]() )中含有σ键的数目为5NA
)中含有σ键的数目为5NA
D.二茂铁分子中的化学键有极性共价键、非极性共价键和配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池总反应为4Al+3O2+6H2O=4Al(OH)3。下列说法不正确的是( )
A.正极的电极反应为O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大其与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1molA和1molB在一个容积可变的容器中发生反应:A(g)+2B(g)![]() 2C(g)。一段时间后达到平衡,生成amolC。下列说法不正确的是( )
2C(g)。一段时间后达到平衡,生成amolC。下列说法不正确的是( )
A.起始时和达到平衡时容器中的压强之比为1:1
B.平衡时物质A、B的转化率之比为1:2
C.平衡时A的转化率为![]()
D.当v正(A)=v逆(B)时,可判定反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如方程式①②所示:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H=+49.0kJmol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g);△H=-192.9kJmol-1
O2(g)=CO2(g)+2H2(g);△H=-192.9kJmol-1
③H2(g)+![]() O2(g)=H2O(g);△H=-241.8kJmol-1
O2(g)=H2O(g);△H=-241.8kJmol-1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9kJmol-1
B.反应①中的能量变化如图所示
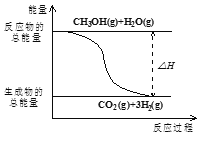
C.CH3OH转变成H2的过程一定要吸收能量
D.根据以上反应可知:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)的△H=-676.5kJmol-1
O2(g)=CO2(g)+2H2O(g)的△H=-676.5kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是( )mol/L
A. 0.15 B. 0.225 C. 0.35 D. 0.45
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验用图甲装置探究工业制乙烯的原理和乙烯的主要化学性质,用图乙装置探究苯与液溴的反应。请回答下列问题:
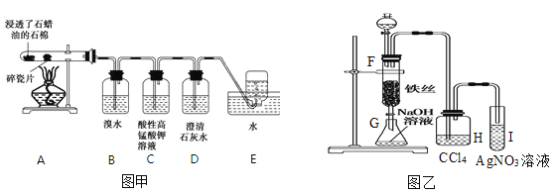
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。
例如:石油分馏产物之一的十六烷烃发生反应: C16H34 ![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为________,乙的结构简式为_____________。
4乙,则甲的分子式为________,乙的结构简式为_____________。
(2)B装置中的实验现象可能是_____,写出反应的化学方程式:_____,其反应类型是____。
(3)实验反应完毕后I试管中的现象是__________。
(4)检验甲烷和乙烯的方法是________(选填字母下同),除去甲烷中乙烯的方法是__________。
A.气体通入水中 B.气体通过盛溴水的洗气瓶 C.气体通过盛酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(5)根据乙烯和苯的性质写出以下反应的化学方程式:
由乙烯制氯乙烷 :__________________, 由苯制硝基苯 :______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积均为2L的恒容密闭容器Ⅰ和Ⅱ,向Ⅰ中加入1molCO和2mol![]() ,向Ⅱ中加入2molCO和4mol
,向Ⅱ中加入2molCO和4mol![]() ,均发生下列反应并建立平衡:
,均发生下列反应并建立平衡:![]()
![]() 。测得不同温度下CO平衡转化率如图所示,下列说法正确的是
。测得不同温度下CO平衡转化率如图所示,下列说法正确的是![]()
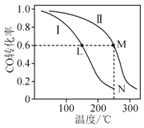
A.根据题干中信息,可推断该反应的![]()
B.反应中L、M两点容器内压强:![]()
C.可以计算出该反应处于N点时,化学平衡常数约为![]()
D.向N点平衡体系中再加入1mol![]() ,新平衡时氢气的增加量小于
,新平衡时氢气的增加量小于![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的表示及说法正确的是
A. 已知![]()
![]() ,则氢气的燃烧热为-241.8kJ/mol
,则氢气的燃烧热为-241.8kJ/mol
B. ![]() 、101 kPa时,求算固态碳和硫的燃烧热时.其分别燃烧时生成稳定的
、101 kPa时,求算固态碳和硫的燃烧热时.其分别燃烧时生成稳定的![]() 和
和![]()
C. 含![]() 的稀溶液与稀硫酸完全中和,放出
的稀溶液与稀硫酸完全中和,放出![]() 的热量,则表示该反应的中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)
的热量,则表示该反应的中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ![]()
D. 已知![]()
![]() ,
,![]()
![]() ,则
,则![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com