
分析 由Am+和Bn-它们的核外电子排布相同,则A在下一周期的前面,B在上一周期的后边,且ZA-m=ZB+n,则ZA-ZB=m+n,再由最高正价态来分析族,以此来解答.
解答 解:①Am+和Bn-它们的核外电子排布相同,故A原子比B原子多一个电子层,故二者的周期数之差为1,
故答案为:1;
②由核电荷数=原子序数=核外电子数,ZA-m=ZB+n,则ZA-ZB=m+n,
故答案为:m+n;
③B的族序数为8-n,A的族序数为m,B和A的族序数之差为8-n-m.
故答案为:8-n-m.
点评 本题考查位置、结构、性质,熟悉原子结构、核电荷数、原子序数、核外电子数的关系即可解答,明确核外电子排布相同是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 241Am的中子数与电子数之差为146 | B. | 241Am与243Am的质子数相等 | ||
| C. | 241Am与243Am是同素异形体 | D. | 241Am与243Am的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
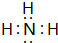 ,请用电子式表示A与C形成化合物的过程
,请用电子式表示A与C形成化合物的过程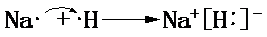 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量SO2通入氨水和硝酸钡的混合溶液中产生白色沉淀,说明NO3-将SO2氧化生成了硫酸钡 | |
| B. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| C. | 为除去乙酸乙酯中混有的少量乙酸杂质,可向混合溶液中加入适量的乙醇并加热 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
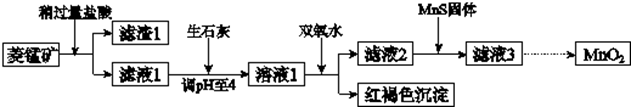
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
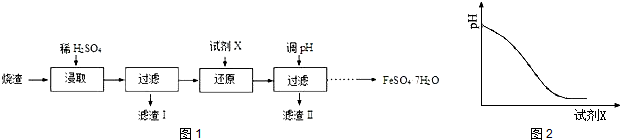
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
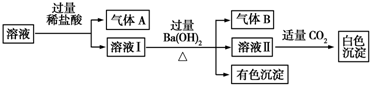
| A. | A是CO2,B是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NO3-、NH4+ | |
| D. | 溶液中一定不存在Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)
侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com