
分析 (1)芒硝(Na2 SO4•10H2O)的分解能把太阳能转化为化学能,故为吸热反应,故△H>0,即Q>0;
(2)根据热化学方程式的书写方法可知,物质的物质的量与反应放出的热量成正比,并注意标明各物质的聚集状态来解答;
(3)已知在25℃、101kPa时:
①C(石墨)+$\frac{1}{2}$O2(g)═CO(g)△H1=-111kJ/mol
②C(石墨)+O2(g)=CO2(g)△H 2=-394kJ/mol,②-①得,CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ/mol.
解答 解:(1)芒硝(Na2 SO4•10H2O)的分解能把太阳能转化为化学能,故为吸热反应,故△H>0,即Q>0,
故答案为:>;
(2)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ/mol,
故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ/mol;
(3)已知在25℃、101kPa时:
①C(石墨)+$\frac{1}{2}$O2(g)═CO(g)△H1=-111kJ/mol
②C(石墨)+O2(g)=CO2(g)△H 2=-394kJ/mol,②-①得,CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ/mol,
故答案为:-283.
点评 本题考查了反应热的判断,盖斯定律的应用,题目难度不大,根据已知方程式构建目标方程式是解题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.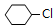 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$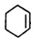 +NaCl+H2O.
+NaCl+H2O.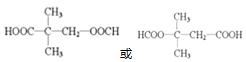 (写出其中一种的结构简式).
(写出其中一种的结构简式).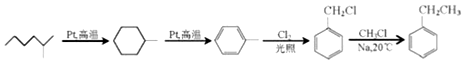 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.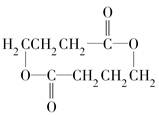 +2H2O.
+2H2O.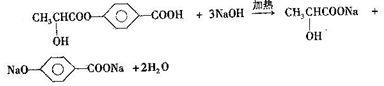 .
.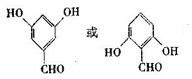 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应放热 | |
| B. | 达到平衡时,容器I中反应物转化率比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的正反应速率比容器I中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的汽化热为40.69 kJ•mol-1,则H2O(g)?H2O(l)△H=40.69 kJ•mol-1 | |||||||||||
| B. | 已知:
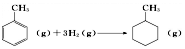 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| C. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||||
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的平衡浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=92.4 | C. | 2p2>p3 | D. | α1+α3<1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL 2mol/L HCl | B. | 300mL 2mol/L H2SO4 | ||
| C. | 100mL 3mol/L HNO3 | D. | 500mL 18.4mol/L H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1mol/L NaHSO3溶液中含有HSO3-离子数为0.1NA | |
| B. | 50 mL 18.4 mol•L-1浓硫酸与足量铜反应,生成SO2分子数为0.46 NA | |
| C. | 1 mol H2和1 mol I2充分反应,可得到HI分子数为2NA | |
| D. | 2.2 g CO2与足量镁粉反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
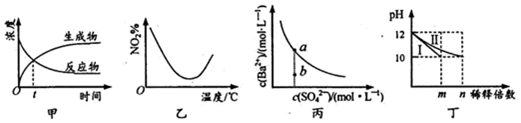
| A. | 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态 | |
| B. | 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)?N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O | |
| C. | 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点 | |
| D. | 图丁表示分别稀释l0mLpH均为12的NaOH和NH3•H2O溶液时pH的变化,曲线I表示NH3•H2O溶液,n>100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com