
【题目】()下表是25℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为___。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是(填“>”、“<”或“=”):CH3COOK___NaClO,两溶液中:[c(Na+)-c(ClO-)]___[c(K+)-c(CH3COO-)]。
(3)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=___。
(4)碳酸钠溶液中滴加少量氯水的离子方程式为___。
(Ⅱ)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
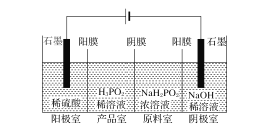
(1)写出阳极的电极反应式___。
(2)分析产品室可得到H3PO2的原因___。
【答案】c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) > = 5 2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3- 2H2O-4e-=O2↑+4H+ 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2
【解析】
()(1)反应后溶质为KHC2O4,所得溶液呈酸性,说明HC2O4-的电离程度大于其水解程度,又氢离子来自水的电离和草酸氢根离子的电离,则:c(H+)>c(C2O42-)>c(OH-);
(2)根据醋酸和次氯酸的电离平衡常数判断二者酸性强弱,酸性越强,对应的酸根离子的水解程度越弱,据此判断pH相同时醋酸钾和次氯酸钠的浓度大小;根据电荷守恒判断浓度关系;
(3)根据醋酸的电离平衡常数进行计算;
(4)依据电离平衡常数判断出的酸性H2CO3 >HClO>HCO3-,依据酸性强弱分析反应产物,然后写出反应的离子方程式;
(Ⅱ)(1)阳极发生氧化反应,水电离的OH-失去电子;
(2)阳极室产生H+,H+通过阳膜进入产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2。
()(1)H2C2O4与含等物质的量的KOH的溶液反应后溶质为KHC2O4,所得溶液呈酸性,则HC2O4-的电离程度大于其水解程度,再结合氢离子来自水的电离和草酸氢根离子的电离,则:c(H+)>c(C2O42-)>c(OH-),溶液中离子浓度由大到小顺序为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(2)根据电离平衡常数可知:酸性CH3COOH>HClO,则NaClO的水解程度大于CH3COOK,所以pH相同时CH3COOK的浓度大于NaClO;
由于两溶液的pH相同,则两溶液中氢离子、氢氧根离子的浓度相同,根据电荷守恒可得:[c(Na+)-c(ClO-)]= [c(K+)-c(CH3COO-)],
故答案为:>;=;
(3)醋酸的电离平衡常数Ka=1.8×10-5=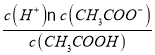 ,已知c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1.8×10-5×
,已知c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1.8×10-5×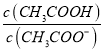 =1×10-5mol/L,则该溶液的pH=5;
=1×10-5mol/L,则该溶液的pH=5;
(4)将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠,反应的离子方程式为:2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-;
(Ⅱ)(1)阳极发生氧化反应,水电离的OH-失去电子,电极反应式为2H2O-4e-=O2↑+4H+;
(2)阳极室产生H+,H+通过阳膜进入产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2。


科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氢氧化铝的两性,最适宜的试剂是( )
A.AlCl3、氨水、稀盐酸B.![]() 、氨水、稀盐酸
、氨水、稀盐酸
C.Al、NaOH溶液、稀盐酸D.![]() 溶液、NaOH溶液、稀盐酸
溶液、NaOH溶液、稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉被氧化。放热引发高氯酸铵反应:2NH4ClO4═N2↑+4H2O+Cl2↑+2O2↑,反应放出大量热。
(1)该反应中被氧化的元素是___和___;
(2)氧化产物与还原产物的质量之比为___;
(3)该反应中若生成标况下2.24LCl2时,电子转移数为___;
(4)若生成的水在高温下也为气态,则混合气体的平均摩尔质量为__g/mol(小数点后保留一位)。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,易溶于水,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
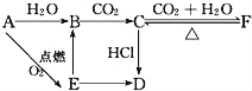
(1)写出A、B、C、D、E、F的化学式:
A.___,B.___,C.___,D.___,E.___,F.___。
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)。
A→E:___,
E→B:___,
F→C:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C均为含铁化合物,请根据以下四种物质的转化过程回答相关问题:
Fe![]() A
A![]() B
B![]() C
C
(1)反应①、③中属于氧化还原反应的是________________(填序号)。
(2)向B的溶液中滴入几滴KSCN溶液后,可观察到的现象是__________。
(3)反应②的离子方程式为 _____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I碘是人类发现的第二个生命科学必需微量元素。回答下列问题:
(1)碘在元素周期表的位置为______________;HF的沸点比HI_________(填“高”或“低”)。原因是_____________________________
(2)自然界中的碘有的以NaIO3形态存在于硝石(NaNO3)中,向硝石母液中加入NaHSO3可以制得I2,请写出NaIO3溶液和NaHSO3溶液反应的离子方程式___________________。
II:2019年有科学家发表在《自然》科学杂志上的研究认为:细菌和灵长类动物铁元素争夺战是物种存活的一个决定性因素。请结合你所学的知识回答下列问题:
(1)铁(26号元素)的原子结构示意图为_______________________
(2)写出氢氧化亚铁接触空气变色过程中发生的化学方程式_________________________
(3)Na2FeO4是新型水处理剂,简述其在水处理中的作用和原因_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 18g氨基(-ND2)中含有的电子数为10NA
B. 一定质量的乙烷与22.4L(标准状况)Cl2在光照条件下发生取代反应,形成C-Cl键的数目为2NA
C. 用惰性电极电解100mL0.1mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0.04NA
D. n(H2SO3)和n(HSO3-)之和为1mol的KHSO3溶液中,含有的K+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
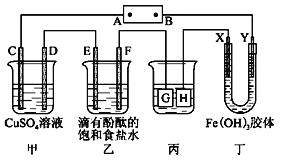
请回答:(1)B极是电源的___极,电极C的电极反应式为:___。
(2)若C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为___。
(3)现用丙装置给铜件镀银,则H电极材料是___(填“铜”或“银”),电镀液是___溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为___。
(4)一段时间后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明__在电场作用下向Y极移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com