
A、 |
B、 |
C、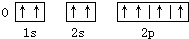 |
D、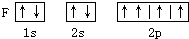 |
 ,故A正确;
,故A正确;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
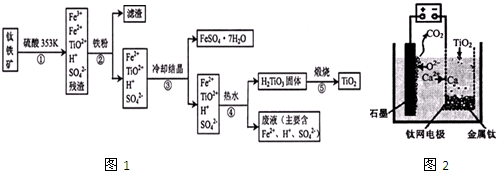
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2溶液和稀H2SO4 |
| B、NH4Cl溶液和NaOH溶液 |
| C、K2CO3溶液和稀H2SO4 |
| D、KI溶液和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
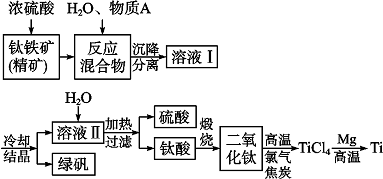
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
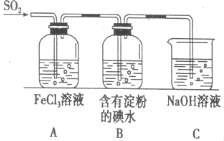 SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
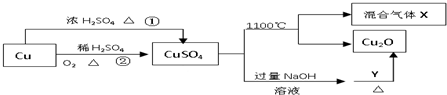
| A、相对于途径①,途径②更好地体现了绿色化学思想 |
| B、Y可以是葡萄糖溶液 |
| C、CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| D、将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com