
| A. | 把铁块换成铁粉 | |
| B. | 将容器的体积压缩至原体积的一半 | |
| C. | 若保持压强不变,充入氮气使容器的体积增大 | |
| D. | 若保持体积不变,充入氮气使容器内的压强增大 |
分析 对于3Fe(s)+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4(s)+4H2(g)来说,增大压强、浓度、升高温度以及增大固体的表面积,都可增大反应速率,以此解答.
解答 解:A.把铁块变成铁粉,固体表面积增大,反应速率增大,故A不选;
B.将容器的体积缩小一半,气体浓度增大,反应速率增大,故B不选;
C.压强不变,充入氮气使容器体积增大,则容器体积应增大,气体浓度减小,反应速率减小,故C不选;
D.体积不变,充入氮气使容器压强增大,反应物和生成物浓度不变,则反应速率不变,故D选.
故选D.
点评 本题考查化学反应速率,为高频考点,侧重于学生的分析能力和基本理论、概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累,易错点为C,注意压强与浓度的关系.


科目:高中化学 来源: 题型:解答题
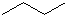
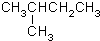
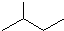 CH3CH=CHCH3
CH3CH=CHCH3
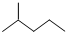 分子式C6H14用系统命名法对该有机物进行命名2-甲基戊烷
分子式C6H14用系统命名法对该有机物进行命名2-甲基戊烷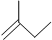 分子式C5H10③
分子式C5H10③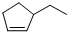 分子式C7H12
分子式C7H12查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加NaCl溶液 | B. | 加水 | ||
| C. | 升高温度(不考虑盐酸挥发) | D. | 滴入几滴浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al3+、H+、AlO2-、Cl- | B. | Cu2+、Fe2+、ClO-、SO42- | ||
| C. | Na+、Ca2+、HCO3-、Cl- | D. | Cu2+、Fe3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K3C60中既有离子键又有非极性键 | |
| B. | 1mol K3C60中含有的离子数目为3NA | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式不能写作KC20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.653 | 42.875 |
| A | B | C | D | |
| n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
| n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
| n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
| n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
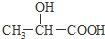 )和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )
)和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )| A. | 2 mol | B. | 2.25 mol | C. | 3 mol | D. | 3.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
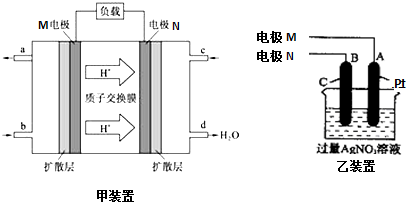
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com