
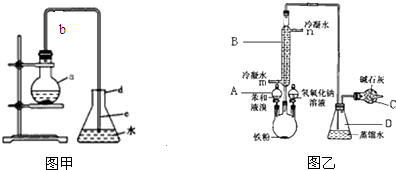
 某学习小组为探究部分元素化合物的性质,设计了下面的实验装置:
某学习小组为探究部分元素化合物的性质,设计了下面的实验装置:分析 (1)仪器B的名称是圆底烧瓶;
(2)实验室用浓硫酸和亚硫酸钠制取二氧化硫,二氧化硫具有还原性,能被强氧化性物质氧化,还具有氧化性,能氧化还原性物质;
(3)氯气具有强氧化性,能氧化溴离子生成溴,也能氧化碘离子生成碘单质.
解答 解:(1)仪器B的名称是圆底烧瓶,故答案为:圆底烧瓶;
(2)实验室用浓硫酸和亚硫酸钠制取二氧化硫,则A中加入试剂是浓硫酸;二氧化硫具有还原性,能被强氧化性物质氧化,酸性高锰酸钾溶液具有强氧化性,则二氧化硫能还原酸性高锰酸钾溶液而导致酸性高锰酸钾溶液褪色;二氧化硫还具有氧化性,能氧化还原性物质,硫化钠具有还原性,二氧化硫和硫化钠发生氧化还原反应生成S单质,该反应中二氧化硫体现氧化性,所以装置乙、丙分别装有KMnO4溶液、Na2S溶液,其实验目的分别是探究二氧化硫的还原性、氧化性,
故答案为:浓硫酸;二氧化硫的还原性;二氧化硫的氧化性;
(3)氯气具有强氧化性,能氧化溴离子生成溴,则乙中离子反应方程式为Cl2+2Br-=Br2+2Cl-;氯气也能氧化碘离子生成碘单质,则丙中现象为:溶液由无色变为紫色,
故答案为:Cl2+2Br-=Br2+2Cl-;溶液由无色变为紫色.
点评 本题考查性质实验方案设计,侧重考查实验基本操作、物质性质,明确物质性质是解本题关键,注意:二氧化硫具有氧化性、还原性和漂白性,二氧化硫的漂白性具有暂时性特点.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:解答题
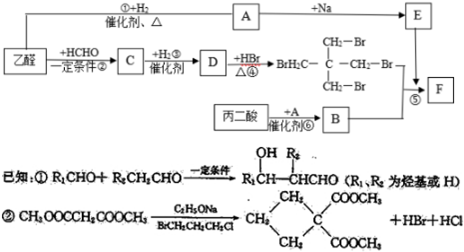
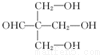 .
. .
.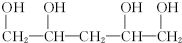 .
.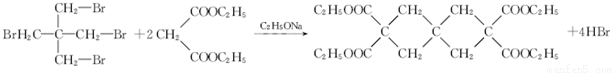 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白:
如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3 $\stackrel{高温}{→}$CaO $\stackrel{{H}_{2}O}{→}$Ca(OH)2$→_{过滤}^{N{a}_{2}C{O}_{3}溶液}$ NaOH溶液 | |
| B. | Cu$→_{△}^{O_{2}}$CuO$→_{△}^{H_{2}SO_{4}}$CuSO4溶液$→_{过滤}^{NaOH溶液}$Cu(OH)2沉淀 | |
| C. | KMnO4$\stackrel{△}{→}$O2$\stackrel{s}{→}$SO2$\stackrel{{H}_{2}O}{→}$H2SO3 | |
| D. | BaCO3$\stackrel{盐酸}{→}$BaCl2溶液$\stackrel{NaOH溶液}{→}$Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com