

| A.该装置中Cu极为正极 |
| B.当铜极的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L |
| C.b极反应的电极反应式为:H2-2e-=2H+ |
| D.一段时间后锌片质量减少 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| A.溶液中Na+向B极移动 |
| B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 |
| C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 |
| D.若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目略大于0.2NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
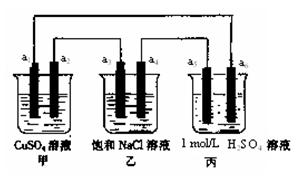
| A.a2电极上有亮红色固体 |
| B.a1、a3电极上产生的物质,物质的量比是1:2 |
| C.丙中的SO42-向a6电极移动 |
| D.当装置电路中有6.02×1021个电子通过时,乙中溶液的pH是13 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.给反应体系适当加热 | B.向反应体系中加水稀释 |
| C.向反应体系中加入适量浓盐酸 | D.将铁片换成铁粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在原电池的负极和电解池的阴极上都是发生氧化反应 |
| B.铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
| C.用惰性电极电解饱和NaCl溶液,若有2mol电子转移,则生成1molNaOH |
| D.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
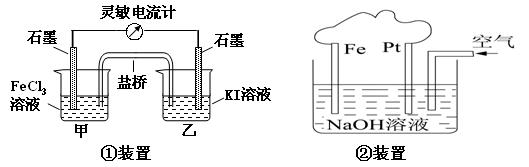

| A.①装置的总反应为2Fe3++2I-=2Fe2++I2 |
| B.②装置中Fe为阴极,电极反应为 Fe-2e-+ 2OH-=Fe(OH)2 |
| C.③装置中外电路电子由b极流向a极 |
| D.④装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com