
A.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果
B.离子方程式不仅可以表示一定物质问的某个反应,而且可以表示所有同一类型的离子反应
C.除了加入电解质可使某些胶体聚沉外,将两种带相反电荷的胶体混合,也能发生聚沉
D.不同的化学反应,具有不同的反应速率,这说明参加反应的物质的性质是决定化学反应速率的重要因素
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
- 2 |
- 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
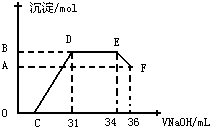
查看答案和解析>>
科目:高中化学 来源: 题型:
A.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果
B.离子方程式不仅可以表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应
C.除了加入电解质可使某些胶体聚沉外,将两种带相反电荷的胶体混合,也能发生聚沉
D.不同的化学反应具有不同的反应速率,这说明参加反应的物质的性质是决定化学反应速率的重要因素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com