
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是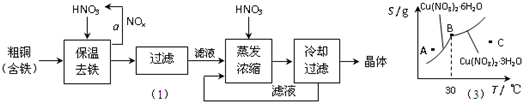
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| H | + 4 |
| H | - 2 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省高三全真高考模拟(五)(理综)化学部分 题型:填空题
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
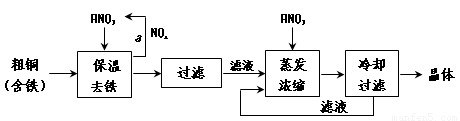
①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明) 。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
(3)图-2是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是 (填字母)。
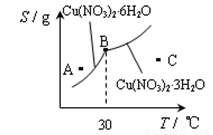
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c. 按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d. 若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省高三第三次模拟考试(理综)化学部分 题型:填空题
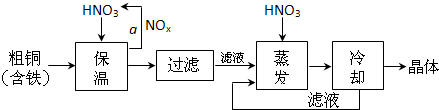
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
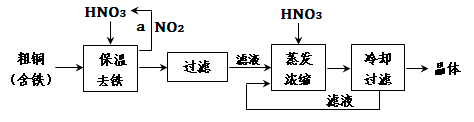
①在步骤a中,还需要通入氧气和水,其目的是 .
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明) 。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
(3)在硝酸铜溶液中,各种离子浓度由大到小的顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com