
【题目】已知在25℃,101kPa下,1gC8H28(辛烷)燃烧生成二氧化碳和液态水时放出48.4kJ热量.表示上述反应的热化学方程式正确的是
A. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) △H=-5517.6 KJ·mol—1
O2(g)===8CO2(g)+9H2O(l) △H=-5517.6 KJ·mol—1
B. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) △H=-48.4 KJ·mol—1
O2(g)===8CO2(g)+9H2O(l) △H=-48.4 KJ·mol—1
C. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) △H=+5517.6 KJ·mol—1
O2(g)===8CO2(g)+9H2O(l) △H=+5517.6 KJ·mol—1
D. C8H28(l)+ ![]() O2(g)===8CO2(g)+9H2O(l) △H=+48.4 KJ·mol—1
O2(g)===8CO2(g)+9H2O(l) △H=+48.4 KJ·mol—1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。现有下列两种制备ClO2的方法:
(1)方法一:可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是_______________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因____________________________________。
(2)方法二:氯化钠电解法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②该法工艺原理示意图如图所示。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2,二氧化氯发生器中生成ClO2的化学方程式为_________________________________。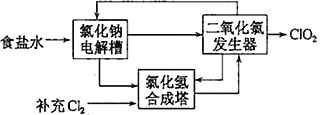
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知物质A、B、C、D、E、F在一定条件下的关系如下图所示,该六种物质的焰色反应均呈黄色。
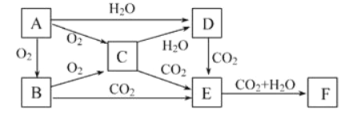
(1)写出下列物质的名称:B____________、E_____。
(2)写出E→F的离子方程式________________________。
F(固体)→E的化学方程式_____________。
(3)写出C与二氧化碳反应的化学方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为常见的金属单质,根据下图所示的关系:
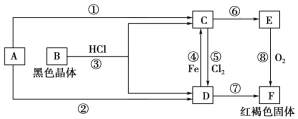
下列叙述中不正确的是
A. A为Fe,B为Fe3O4
B. C→D溶液的颜色变化:由浅绿色到黄色
C. ④的离子方程式:Fe+Fe3+===2Fe2+
D. ⑧的化学方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入400 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
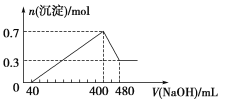
计算:
(1)合金中Mg的质量为________g;
(2)硫酸的物质的量浓度为________ mol·L1;
(3)NaOH溶液的物质的量浓度为________ mol·L1;
(4)生成H2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
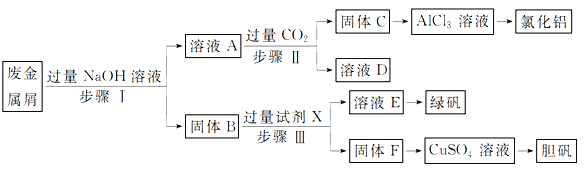
请回答:
(1)写出步骤Ⅰ反应的离子方程式:____________________________。
(2)试剂X是______________。溶液D是______________。
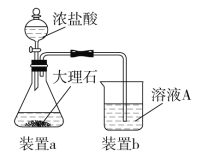
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是_____________________。
(4)由固体F制取硫酸铜溶液,通常有两种方案:
方案一:将固体F在加热条件下与浓硫酸反应;
方案二:将固体F投入热的稀浓硫酸中,然后通入氧气;
方法一的缺点为:_________________________________________________。
(5)工业上常用溶液E制得净水剂Na2FeO4,流程如下:

①测得溶液E中c(Fe2+)为0.2 mol·L-1,若要处理1 m3溶液E,理论上需要消耗25%的H2O2溶液_______kg。
②写出由Fe(OH)3制取Na2FeO4的离子方程式______________。(已知NaClO还原为NaCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤造成的S2的大量排放已经给我们的生存环境造成了严重破坏,科学研究发现:一定条件下,通过下列反应可实现燃煤烟气中硫的回收。
(1)已知:2CO(g)+2O2(g)=2CO2g) △H1=-566kJ/mol
S(l)+O2(g)=SO2(g) △H2=--296kJ/mol
则反应2CO(g)+SO2(g) ![]() 2CO2(g)十S(l) △H=________ kJ/mol
2CO2(g)十S(l) △H=________ kJ/mol
(2)燃煤烟气中硫的回收反应的平衡常数表达式K=_________。在温度和容积不变时,下列说法正确的是_________ (填字母序号)
A.容器内压强不再改变时,反应达到平衡状态
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.当n((CO):n(SO2):n(CO2)=2:1:2时,反应达到平衡状态
D.其他条件不变,使用不同催化剂,该反应平衡常数变化
(3)假设在容器中发生上述反应,下列能提高SO2转化率的是_________(填字母序号)。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.增大容器的体积
(4)SO2尾气处理的方法之一是将尾气直接通入NaOH溶液中。若将 1mol SO2气体通入1L2mo1/L的NaOH溶液中所得溶液中离子浓度由大到小的顺序为_____________;
(5)尾气中的CO可以制成CO-----空气燃料电池。CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—。该电池负极的电极反应式为_______________;总反应式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸分别测定浓度为18mol/L和0.1 mol/L H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
D | 向盛有1mL 0.01 mol/L | 证明在相同温度下的 Ksp(AgCl)>Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为短周期表的一部分,其中E为地壳中含量最高的元素。

请完成下列问题:
(1)D元素在元素周期表中的位置______________。
(2)A、E简单离子的半径由大到小顺序为___________(用具体的微粒符号表示,下同)。
(3)写出A和F两种元素的最高价氧化物的水化物相互反应的离子方程式_________。
(4)写出将过量C的最高价氧化物通入含B的盐溶液中的离子方程式____________。
(5)证明元素F和G的非金属性强弱(用化学方程式表示)___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com