

分析 硫铁矿烧渣的主要成分为Fe、Fe2O3、SiO2、Al2O3,根据图示可知,足量的试剂X用于除去二氧化硅和氧化铝,然后用足量稀硫酸溶解铁和氧化铁,所以试剂X应该为NaOH溶液,溶液1为硅酸钠和偏铝酸钠溶液,2.72g固体为铁和氧化铁的混合物,加入稀硫酸后氧化铁与部分铁粉、稀硫酸反应生成硫酸亚铁,剩余的铁粉与稀硫酸反应生成硫酸亚铁和氢气,
(1)操作a是将难溶物与溶液分离,据此判断操作方法;
(2)试剂X为氢氧化钠溶液,氧化铝和二氧化硅都能够与氢氧化钠溶液反应,分别写出氧化铝、二氧化硅与氢氧化钠溶液反应的离子方程式;
(3)向溶液2中滴加KSCN溶液,无明显现象,说明反应生成硫酸亚铁,发生反应有:铁与铁离子反应生成亚铁离子,铁与氢离子反应生成亚铁离子和氢气,据此写出反应的离子方程式;
(4)设出铁、氧化铁的物质的量,分别根据反应的离子方程式列式计算出铁元素的物质的量,再根据m=nM计算出铁元素的质量,最后计算出硫铁矿烧渣中铁元素的质量分数.
解答 解:硫铁矿烧渣的主要成分为Fe、Fe2O3、SiO2、Al2O3,根据图示可知,足量的试剂X用于除去二氧化硅和氧化铝,然后用足量稀硫酸溶解铁和氧化铁,所以试剂X应该为NaOH溶液,溶液1为硅酸钠和偏铝酸钠溶液,2.72g固体为铁和氧化铁的混合物,加入稀硫酸后氧化铁与部分铁粉、稀硫酸反应生成硫酸亚铁,剩余的铁粉与稀硫酸反应生成硫酸亚铁和氢气,
(1)操作a是将不溶物与溶液分离,该操作方法为过滤,故答案为:过滤;
(2)X为强氧化钠溶液,氧化铝、二氧化硅都与氢氧化钠溶液反应,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;SiO2+2OH-=SiO32-+H2O;
(3)向溶液2中滴加KSCN溶液,无明显现象,证明反应后生成了硫酸亚铁,涉及的氧化还原反应的离子方程式有:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,
故答案为:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑;
(4)设铁的物质的量为x,氧化铁的物质的量为y,标况下224mL的物质的量为:$\frac{0.224L}{22.4L/mol}$=0.01mol,根据反应Fe+2H+=Fe2++H2↑可知,生成0.01mol氢气消耗铁的物质的量为0.01mol,则参与反应Fe+2Fe3+=3Fe2+的铁的物质的量为:x-0.01mol,则:①x-0.01mol=y,
根据固体质量可得:②56x+160y=2.72,联立①②解得:x=0.02mol、y=0.01mol,
则硫铁矿烧渣中铁元素的质量为:56g/mol×(x+2y)=56g/mol×(0.02mol+0.01×2)=2.24g,
硫铁矿烧渣中铁元素的质量分数为:$\frac{2.24g}{20g}$×100%=11.2%,
故答案为:11.2%.
点评 本题考查了物质制备及探究物质含量方法,题目难度中等,明确实验目的及发生反应原理为解答关键,涉及化学实验基本操作方法、离子方程式书写、化学计算等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验、化学计算能力.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
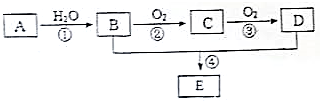 已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种物质E,其合成路线如图所示.
已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种物质E,其合成路线如图所示. .B、D分子中的官能团名称分别是羟基、羧基.
.B、D分子中的官能团名称分别是羟基、羧基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl(Na2CO3) | B. | SiO2(CaCO3) | C. | Cu粉(Mg粉) | D. | KNO3(KCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+,Fe2+,NO3-,SO42- | B. | K+,Na+,Cl-,HCO3- | ||
| C. | K+、Na+、AlO2-、SO42- | D. | K+,NH4+,Cl-,CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的原子半径大于y的原子半径 | |
| B. | x 单质的氧化性小于y单质的氧化性 | |
| C. | x的电负性大于y的电负性 | |
| D. | x的第一电离能小于y 的第一电离能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油的主要成分是高级脂肪酸甘油酯,可用于制肥皂和加工食用油 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | BaSO4在医学上用作钡餐,因此Ba2+对人体无毒 | |
| D. | 液态钠可用作核反应堆的传热介质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com