
| A.NH4+、SO42—、NO3—、H+ | B.I-、NO3—、H+、K+ |
| C.NH4+、Cl-、OH-、NO3— | D.Na+、H+、SO32—、SO42— |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
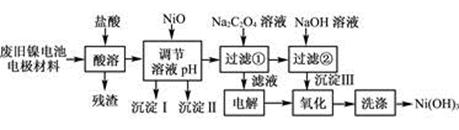
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃时,pH=10的NaOH溶液与pH=10的氨水中:c(Na+)=c(NH4+) |
| B.相同条件下等物质的量浓度的①NaCl 溶液;②NaOH溶液;③HCl溶液中由水电离出的c(H+):③>①>② |
| C.在Na2CO3、NaHCO3两种溶液中,离子种类不相同 |
| D.25℃时,浓度为0.2 mol·L-1的Na2CO3溶液中只存在水解平衡,不存在电离平衡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 下列各组离子可能大量共存的是( ):
下列各组离子可能大量共存的是( ):| A.pH=1的溶液中:Fe2+、Al3+、HCO3-、MnO4- |
| B.能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ |
| C.含有大量OH-的无色溶液中:Na+、Cu2+、AlO2-、SiO32- |
| D.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4+ 、Fe3+ 、SO42— 、Cl— | B.CO32— 、PO43— 、K+ 、Na+ |
| C.Na+ 、SO42— 、NO3— 、Cl— | D.HPO42— 、Na+ 、 HSO3— 、K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、NH4+、I-、HCO3- | B.Ba2+、H+、Cl-、Al3+ |
| C.H+、Ca2+、Fe3+、NO3- | D.Na+、Ca2+、K+、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com