
 cC(g) +dD(g),△H=Q,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示据图分析,以下正确的是
cC(g) +dD(g),△H=Q,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示据图分析,以下正确的是 
| A.T1>T2,Q>0 | B.Tl<T2,Q<0 |
| C.P1>P2,a+b=c+d | D.Pl<P2,b=c+d |
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源:不详 题型:填空题
 xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 试计算:
xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 试计算:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.加催化剂同时升高温度 |
| B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 |
| D.降低温度同时增大压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
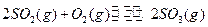
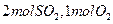 ,达平衡时生成
,达平衡时生成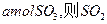 的转化率为 。
的转化率为 。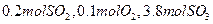 ,达平衡时SO2的物质的量为 mol。
,达平衡时SO2的物质的量为 mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
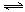 CO(g) + H2(g)
CO(g) + H2(g)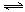 CO2(g) + H2(g) 当反应达平衡时测得c(H2) ="1.9" mol/L,c(CO) =" 0.1" mol/L。则CO2的浓度为
CO2(g) + H2(g) 当反应达平衡时测得c(H2) ="1.9" mol/L,c(CO) =" 0.1" mol/L。则CO2的浓度为| A.0.1 mol/L | B.0.9 mol/L | C.1.8 mol/L | D.1.9 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度关系如图所示。下列说法正确的是
2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度关系如图所示。下列说法正确的是
| A.此反应的正反应是吸热反应 |
| B.反应在T1温度时达到平衡 |
| C.T3温度时正反应速率大于逆反应速率 |
| D.T3温度时正反应速率大于T1温度时正反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NO2(g) △H>0,
2NO2(g) △H>0,| A.温度不变体积减小,反应速率增大,再次平衡时混合气颜色变浅 |
| B.温度和体积不变,加入少许NO2,再次平衡时混合气中NO2的百分含量减少 |
| C.体积不变时加入少许N2O4,再度平衡时颜色变深 |
| D.体积不变时升高温度,再次平衡时混合气颜色变深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示
Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示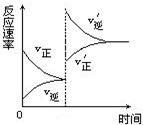 ,则图像中关于X、Y、Z、W四种物质的聚集状态为:
,则图像中关于X、Y、Z、W四种物质的聚集状态为:
| A.Z、W均为气体,X、Y中有一种是气体 |
| B.Z、W中有一种是气体,X、Y皆非气体 |
| C.X、Y、Z、W皆非气体 |
| D.X、Y均为气体,Z、W中有一种为气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
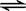 H++CH3COO-,加入少量下列物质平衡不发生移动的是
H++CH3COO-,加入少量下列物质平衡不发生移动的是| A.NaCl固体 | B.CH3COONa | C.Na2CO3 | D.NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com