
【题目】在一些茶叶的包装盒中有一个小袋,将小袋打开可看到灰黑色粉末,其中有的已变成棕褐色。将这种灰黑色粉末投入稀盐酸后,取其上层清液并加几滴氯水,再滴加KSCN溶液,马上出现红色。以下结论不正确的是 ( )
A.该灰黑色粉末作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
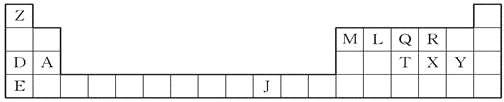
(1)T、X、Y原子的第一电离能由小到大的顺序是____________(用元素符号表示)。
(2)LX2分子的电子式是________________,XY2分子是____________(填“极性分子”或“非极性分子”);QY3分子中Q采用________杂化。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式J(LR)4,其中J的化合价是0价。则基态J原子的核外电子排布式是___________________________;写出与配位体微粒互为等电子体的离子、分子各一种________、________。
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有_________种同分异构体(其中Q以三个单键与其他原子相连),请写出其中沸点最低的物质的结构简式__________________。
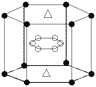
(5)A与M组成的一种化合物AM2,刷新了金属化合物超导温度的最高纪录。右图所示的是该化合物的晶体结构单元。图中上下底面中心“△”处的原子是________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,氧化产物为___________,若有3mol FeS2参加反应,转移_____mol电子。
6SO2+Fe3O4,氧化产物为___________,若有3mol FeS2参加反应,转移_____mol电子。
②与明矾相似,硫酸铁也可用作净水剂,其原理为:___________(用离子方程式表示)。
③FeC13与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________。
(2)己知:S2O32-具有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为:
S2O82-+2I-=2SO42-+I2 ① I2+2S2O32-=2I-+S4O62- ②
S2O82-、S4O62-、I2氧化性强弱顺序_______。
(3)己知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
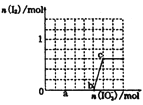
①a点处的还原产物是:________(填离子符号);
b点→c点反应的离子方程式是________。
②当溶液中的I-为0.5mol时、加入的KIO3可能是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx都是大气污染物。
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是_________________________________________;
(2)采取还原法,用炭粉可将氮氧化物还原.
已知:N2(g)+O2(g)=2NO(g)△H=+180.6kJmol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1
则反应C(s)+2NO(g)=CO2(g)+N2(g)△H=__________kJmol-1.
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为_____________(填写“氧化剂”
或“还原剂”).下式中X必须为无污染的物质,系数n可以为0;
NO2+G![]() N2+H2O+nX (未配平的反应式);
N2+H2O+nX (未配平的反应式);
下列化合物中,满足上述反应式中的G是________(填写字母);
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)利用氨水可以将SO2和NO2吸收,原理如图1所示:NO2被吸收的离子方程式是______________;
(5)利用图2所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2.
①b极的电极反应式为__________________________;
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.该反应离子方程式为__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________________。
(2)装置乙,若电路中转移6.02×1022个e﹣,则C上增加的质量为 。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁。
某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如下探究实验,
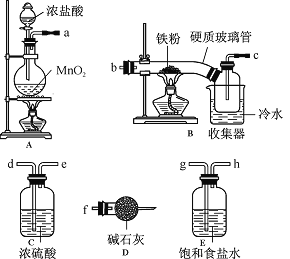
请回答下列问题:
(1)装置的连接顺序为 (用a、b、c…h表示)。
(2)i.E中饱和食盐水的作用是 。
ii.D中碱石灰的作用是 。
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得FeCl3进入收集器,需进行的操作是 。
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
![]()
①淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是 (用离子方程式表示)。
(5)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明 ;
实验②的目的是 ;
得出结论: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)下图由短周期元素形成的物质之间的转化关系,其中A、D、L为单质,其他为化合物。其中化合物I、J、K中含有两种相同的元素,G和I的反应⑤是一种重要化工生产中的主要反应之一。B常温下为液态化合物,F是一种直线型的非极性气体分子。
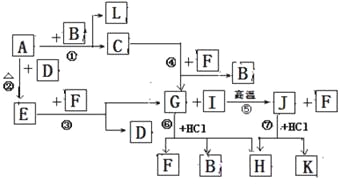
试回答下列有关问题:
(1)以上7个化学反应属于同种元素自身氧化还原反应的是 ;(用编号①→⑦填写)
(2)在G、J、H中含有相同的元素是 (填元素名称);
(3)J的水溶液和F______(填“能”或”否”)发生反应,其理由是 ;
(4)写出电解溶液H的离子反应方程式 ;
(5)反应⑤的化学方程式是 ;
(6)写出J的两种常见用途 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于吸热反应X+Y=Z+W(Ex、EY、Ez、Ew分别代表X、Y、Z、W所具有的能量),以下说法一定正确的是 ( )
A.Ex<Ez+Ew
B.Ey>Ez+Ew
C.Ex+EY>Ez+Ew
D.Ex+Ey<Ez+Ew
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com