
【题目】(1)KClO3 + 6HCl(浓) = KCl + 3Cl2 + 3H2O中氧化剂是__________,还原剂是__________,请用双线桥表示电子转移数目_________________。当有l mol Cl2生成时,氧化剂与还原剂的物质的量之比为____________。
(2)3NO2 + H2O = 2HNO3 + NO中当电子转移4mol时,参加还原反应的NO2有__________mol,氧化产物与还原产物物质的量之比为__________。
【答案】KClO3 HCl  1:5 6 2:1
1:5 6 2:1
【解析】
(1)反应KClO3 + 6HCl(浓) = KCl + 3Cl2 + 3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子,以此解答该题;
(2)反应二氧化氮中氮元素化合价既升高也降低,二氧化氮既作氧化剂又作还原剂,3mol的NO2中,2mol做还原剂,1mol做氧化剂,转移的电子为2mol,以此解答该题。
(1)反应KClO3 + 6HCl(浓) = KCl + 3Cl2 + 3H2O中,只有Cl元素化合价发生变化,KClO3为氧化剂,HCl为还原剂,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,当有1mol Cl2生成时,氧化剂与还原剂的物质的量之比为
,当有1mol Cl2生成时,氧化剂与还原剂的物质的量之比为![]() mol:
mol:![]() mol=1:5;
mol=1:5;
(2)3NO2+H2O=2HNO3+NO中,只有N元素的化合价变化,由生成NO可知,生成1molNO时转移2mol电子且有3molNO2反应,当电子转移4mol时,参加还原反应的NO2有6mol,HNO3为氧化产物,NO为还原产物,由反应可知,氧化产物与还原产物物质的量之比为2:1。


科目:高中化学 来源: 题型:
【题目】从自然界直接获取的能源称为一次能源,一次能源经加工、转换得到的能源称为二次能源。下列说法不正确的是
A.天然气、太阳能都是一次能源,而氢气是二次能源
B.吸热反应都需要加热到一定温度后才能进行的说法是不正确的
C.用水一次性就能区分出氯化钠、氢氧化钠、硝酸铵、碳酸钙四种固体
D.常温常压下,1molC2H2完全燃烧时放出热量为1299.6kJ,则表示乙炔完全燃烧的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)△H=-2599.2kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与 pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与 pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(选填序号,下同),水的电离程度相同的是_________;
(2)若将②、③混合后所得溶液 pH=7,则消耗溶液的体积:②______③(选填“>”、“<”或“=”,下同);若将②、③溶液等体积混合后,所得溶液 pH_____________7。
(3)若将①、④溶液按体积比为2:1混合后,所得溶液pH______7(选填“>”、“<”或“=”)此时溶液中除水分子外的各微粒的浓度由大到小的顺序为:__________;将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈_________(填序号)。
A.酸性 B.碱性 C.中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温,0.1mol/Lt溶液与0.1mol/L u溶液的pH均为1,下列说法正确的是( )
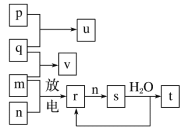
A. 元素的非金属性:Z>Y>X,原子半径:X<Z<Y
B. Y、W的氧化物对应的水化物均为强酸
C. s溶于水的反应中,氧化剂与还原剂的物质的量之比为2∶1
D. v的电子式可表示为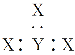
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G、H、I等全部由短周期元素组成的九种常见物质。已知:①其中只有B、C、F为单质,且常温常压下,B为固态,C、F为气态;②化合物中仅A、E为气态;③在常温下,D为淡黄色固体;④H的焰色反应呈黄色。它们的转化关系反应条件未注明如图所示:
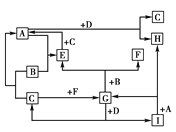
试回答:(1)写出下列物质的化学式:E________,F________,H________,I________。
(2)写出A与D反应的化学方程式:_______________。
(3)写出B与G反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有强氧化性,是一种新型多功能水处理剂,其生产工艺流程如下:
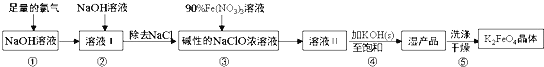
已知:K2FeO4在水溶液中易发生反应:4FeO42+10H2O4Fe(OH)3+8OH-+3O2↑,下列说法不正确的是( )
A.步骤③中氧化剂与还原剂的物质的量之比为3:2
B.步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小
C.步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制
D.配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒、胶头滴管等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表代表周期表中的几种短周期元素,下列说法中错误的是

A. A、B、C第一电离能的大小顺序为C>B>A
B. C、D气态氢化物稳定性强弱和沸点高低均为C>D
C. AD3和ED4两分子的中心原子均为sp3杂化
D. ED4分子中各原子均达8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,D气体能使带火星的木条复燃,X是一种常见的酸式盐。
试填写下列空白:
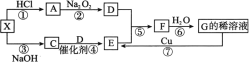
(1) 物质X的名称是___________;检验C气体的方法是___________。
(2) 反应④的化学方程式为___________。
(3) 反应⑥中氧化剂与还原剂的质量之比为___________;反应⑦中氧化剂与还原剂的物质的量之比为___________。
(4) 写出X与足量NaOH溶液反应的离子方程式:____________。
(5) 在标准状况下,在一个干燥的烧瓶内F和D的混合气体[V(F)∶V(D)=4∶1]。然后做喷泉实验,则烧瓶中所得溶液中溶质的物质的量浓度为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com