
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2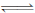 CHCl3 + HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
CHCl3 + HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度 /℃ | 初始CCl4的浓度 /(mol • L﹣1) | 初始H2的浓度/(mol • L﹣1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为___________,在110℃时平衡常数为_____________。
②实验1中,CCl4的转化率A____________50%(填”大于”“小于”或”等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值____________(填序号)。
A.等于50% B.大于50%
C.小于50% D.从本题资料无法判断
(2)120℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol • L﹣1和4 mol • L﹣1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。
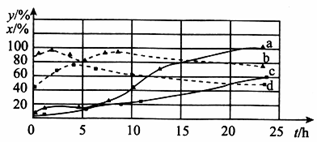
①在图中的四条线中,表示H2的起始浓度为2mol • L﹣1的实验消耗CCl4的百分率变化曲线是___________(填序号)。
②根据上图曲线,氢气的起始浓度为___________mol • L﹣1时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量。你判断的依据是___________。
【答案】(1)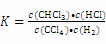 1 ②大于③0.05 mol • L﹣1 • h﹣1 ④D
1 ②大于③0.05 mol • L﹣1 • h﹣1 ④D
(2)①c ②4 从图中可见,4 mol • L﹣1的a、b曲线比2 mol • L﹣1的c、d曲线的CCl4的转化率和产物中CHCl3的百分含量的数值都高
【解析】(1)因CCl4的沸点为77℃ ,CHCl3的沸点为61.2℃,所以在110℃或100℃时反应中各物质的状态均为气态,其平衡常数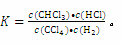 110℃时,由实验2可知反应中各物质的平衡浓度均为0.5 mol • L﹣1,代入表达式计算得平衡常数为1。实验1和实验2的反应温度相同,所以其平衡常数相同,利用平衡常数相等,可以求出实验1中CCl4的平衡转化率,然后与50%比较;对于实验3,因温度不同,又不知该反应的热效应,所以无法判断转化率的大小。
110℃时,由实验2可知反应中各物质的平衡浓度均为0.5 mol • L﹣1,代入表达式计算得平衡常数为1。实验1和实验2的反应温度相同,所以其平衡常数相同,利用平衡常数相等,可以求出实验1中CCl4的平衡转化率,然后与50%比较;对于实验3,因温度不同,又不知该反应的热效应,所以无法判断转化率的大小。
(2)由图像可知,氢气的浓度越大反应速率越快,消耗CCl4的百分率变化就越快,相反就比较慢,所以H2的起始浓度为2 mol • L﹣1时,消耗CCl4的百分率变化曲线是c,CCl4的平衡转化率和产物中CHCl3的百分含量均得到提高的是a和b此时氢气的浓度为4mol • L﹣1。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
下列曲线图与对应选项不正确的是()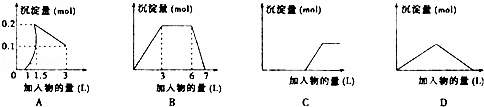
A. 向1L浓度均为0.1mol•L﹣1的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol•L﹣1稀H2SO4溶液
B. 向含有0.1 mol•L﹣1 AlCl3和0.3mol/L NH4Cl的1L混合液中逐滴加入0.1 mol•L﹣1NaOH溶液
C. 向烧碱溶液中逐滴加入明矾溶液
D. 向Ba(OH)2溶液中逐渐通入二氧化碳气体
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为1NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA
C. 通常状况下,1NA个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果.例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢和高碳钢,利用数轴的分类法可将其表示为
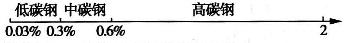
根据这一分类法回答下列问题:
(1)将pH与溶液酸碱性的关系粗略地表示在如下数轴上(常温下):
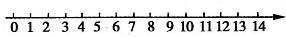
(2)某化学兴趣小组欲研究H2SO4、KCl、Na2SO3、Na2CO3、NaCl、NaOH的性质,对于如何研究,他们设计了两种方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验.
方案Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,边行实验.
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7.由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类,这样划分是否合理?为什么?
②在方案Ⅰ中,某同学发现盐类物质中的KCl和NaCl两种物质,它们在与其他物质混合时现象相同,无法区分,请你设计一种简单的方法区分这两种物质: .
③在方案Ⅱ中,三种钠盐用其他化合物中的H2SO4可加以区分,有关反应的化学方程式分别为 .
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类.在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3,很容易区分,但鉴别NaCl和NaOH时却陷入了困境,请你帮忙解决这一难题(试剂只限于上述六种物质): ;.
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,某溶液中由水电离出的c(H+)= 1× 10﹣11 mol • L﹣1,下列说法中正确的是
| A.该溶液肯定显碱性 | B.该溶液肯定显酸性 |
| C.该溶液的pH可能是11,也可能是3 | D.该溶液的pH肯定不是11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于含苯环的化合物的实验事实中,能说明侧链对苯环性质有影响的是( )
A. 苯酚与浓溴水反应生成三溴苯酚
B. 苯酚能和NaOH溶液反应
C. 苯酚燃烧产生带浓烟的火焰
D. 甲苯能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
将2gNaOH固体溶于水配成250mL溶液,溶液中NaOH的物质的量浓度为( )
|
| A. | 0.04mol/L | B. | 0.2mol/L | C. | 1mol/L | D. | 2m01/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com