
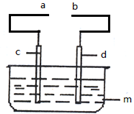
 某小组为研究电化学原理,设计如图所示装置:
某小组为研究电化学原理,设计如图所示装置:分析 (1)Zn与稀硫酸反应置换出氢气;
(2)①c是石墨电极,d是铜片,m是硝酸银溶液,电池中总反应为Cu与银离子的置换反应;
②c、d是Pt电极,m是稀硫酸,分别向两极通入甲烷和氧气,形成燃料电池,通入燃料的为负极;
(3)①电解精炼,粗铜作阳极,精铜作阴极
②电解NaCl溶液时,阴极生成氢气和氢氧根离子,阳极上生成氯气,氯气能使湿润的淀粉KI试纸变蓝;
③电解发生2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,则Cu失电子为阳极.
解答 解:(1)Zn与稀硫酸反应置换出氢气,所以锌片上有大量气泡生成;
故答案为:有大量气泡生成;
(2)①c是石墨电极,d是铜片,m是硝酸银溶液,电池中总反应为Cu与银离子的置换反应,反应离子方程式为:Cu+2Ag+=Cu2++2Ag;
故答案为:Cu+2Ag+=Cu2++2Ag;
②c、d是Pt电极,m是稀硫酸,分别向两极通入甲烷和氧气,形成燃料电池,通入燃料的为负极,则通入甲烷的一极是负极,酸性条件下,甲烷失电子生成二氧化碳和氢离子,则负极的电极反应式为:CH4+2H2O-8e-=CO2+8H+;
故答案为:负极;CH4+2H2O-8e-=CO2+8H+;
(3)①电解精炼,粗铜失电子逐渐溶解,所以粗铜作阳极,铜离子在阴极上得电子,所以精铜作阴极;
故答案为:阴极;
②c、d是石墨电极,m是NaCl溶液,向溶液中滴加几滴酚酞试液,阴极生成氢气和氢氧根离子,所以阴极附近先变红色,则c为阴极,b为阳极,所以b与电源的正极相连,电解的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑;阳极上生成氯气,氯气能使湿润的淀粉KI试纸变蓝,所以用湿润的淀粉KI试纸检验氯气;
故答案为:正极;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑;能使湿润的淀粉KI试纸变蓝;
③通过电解发生2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,则Cu失电子为阳极,阳极的电极方程式为:2Cu+OH--2e-=Cu2O+H+;
故答案为:2Cu+OH--2e-=Cu2O+H+.
点评 本题考查学生化学反应、原电池原理的应用和电解原理的应用,明确原电池和电解池的工作原理及所发生的氧化还原反应是解答本题的关键,题目难度中等,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 硒化氢不稳定 | |
| B. | 酸性强弱顺序:HClO4>H3AsO4>H2SeO4 | |
| C. | 硒与铁反应可生成FeSe | |
| D. | 最高氧化物的化学式是SeO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④③ | B. | ③④②① | C. | ②①④③ | D. | ④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=13 | |
| B. | pH=2 | |
| C. | 由水电离出的c(H+)=0.01 mol/L | |
| D. | 溶质的物质的量浓度为0.005 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C作还原剂,在反应中被氧化 | |
| B. | 每转移2mol e-时,可产生1mol CO | |
| C. | N2作氧化剂,AlN是还原产物 | |
| D. | 欲制得2molAlN,实际消耗N2体积大于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳和甲烷均是造成温室效应的气体 | |
| B. | 可借助于核磁共振氢谱区分乙醇和二甲醚这两种物质 | |
| C. | 漂白液的有效成分是NaClO,制作计算机芯片的材料是SiO2晶体 | |
| D. | 食醋可去除水垢,NH4Cl溶液可去除铁锈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com