
分析 由信息①⑤可知反应有气体,气体只能为CO2,则A为Na2CO3,
其余,先分组:B、E组为HCl、H2SO4,那么C、D组为AgNO3、BaCl2,
据信息②③⑥可知产生的沉淀为AgCl,所以C物质为AgNO3,B为HCl,D为BaCl2,结合其他信息知E为H2SO4,以此解答该题.
解答 解:(1)在②和③的反应中生成的沉淀的化学式为AgCl,故答案为:AgCl;
(2)由上述分析可知,A为Na2CO3,C为AgNO3,D为BaCl2,E为H2SO4,故答案为:Na2CO3;HCl;AgNO3;BaCl2;H2SO4;
(3)某透明纯净溶液中含有SO42-,其检验方法是取试剂少量,先滴加盐酸无现象,后滴加氯化钡溶液,有白色沉淀生成,故答案为:取试剂少量,先滴加盐酸无现象,后滴加氯化钡溶液,有白色沉淀生成.
点评 本题考查无机物的推断,为高频考点,注意根据物质的性质结合反应的现象进行推断,气体为二氧化碳为推断的突破口,学习中注意把握常见元素化合物的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④ | C. | ①③④⑦ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性锌锰干电池属于二次电池 | B. | △H3=△H1+△H2 | ||
| C. | 反应①的活化能为24.4 kJ•mol-1 | D. | △H1<△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
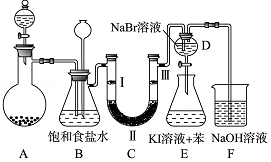 如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略). MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
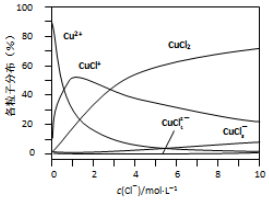
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH试纸使用之前需用蒸馏水润湿 | |
| B. | 用广泛pH试纸测定某溶液的pH为3.5 | |
| C. | pH=7的溶液一定呈中性 | |
| D. | 中性溶液的c(H+)=$\sqrt{K_W}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应 | 离子方程式 | 判断及改正方法 |
| A | CaCO3和醋酸溶液反应 | CaCO3+2H+═Ca2++H2O+CO2↑ | 正确 |
| B | 向Ba(OH)2溶液中加H2SO4溶液 | Ba2++OH-+H++SO42-═BaSO4↓+H2O | 错误:OH-、H+、H2O的化学计量数应均为2 |
| C | 过量的浓氨水加入到AlCl3溶液中 | Al3++3NH3•H2O═3NH4++Al(OH)3↓ | 错误:应生成AlO2-、NH4+、H2O |
| D | 将铜片插入硝酸银溶液中 | Cu+Ag+═Cu2++Ag | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④⑤ | C. | ③④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:
碳和碳的化合物在生产、生活中的应用非常广泛. 现将不同量的CO2(g)和H2(g)分别通入体积为2L的恒容密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| CO2 | H2 | CO | |||
| 1 | 800 | 4 | 2.5 | 1.5 | 5 |
| 2 | 830 | 2 | 2 | 1 | 3 |
| 3 | 830 | 2 | 2 | 1 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com