汽车内燃机工作时产生的电火花和高温会引起反应:N
2(g)+O
2(g)═2NO(g),导致汽车尾气中的NO和NO
2对大气造成污染.
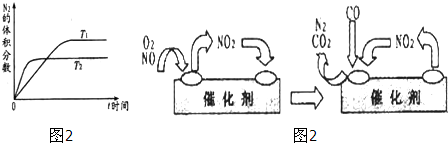
(1)在不同温度(T
1,T
2)下,一定量的NO分解产生N
2和O
2的过程中N
2的体积分数随时间t变化如图1所示.根据图象判断反应N
2(g)+O
2(g)═2NO(g)为
反应(填“吸热”或“放热”),随着温度的升高,该反应的平衡常数K
(填“增大”“减小”或“不变”,平衡向
移动(填“向左”“向右”或“不”).
(2)某温度时,向容积为1L的密闭容器中充入5mol N
2与2.5mol O
2,发生N2(g)+O
2(g)═2NO(g)反应,2min后达到平衡状态,NO的物质的量为1mol,则2min内氧气的平均反应速率为
,该温度下,反应的平衡常数K=
.该温度下,若开始时向上述容器中加入的N
2与O
2均为1mol,则N
2的平衡浓度为
mol/L.
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.写出上述变化中的总化学反应方程式:
.
(4)用CH
4催化还原NO
2的方法也可以消除氮氧化物的污染.例如:
CH
4(g)+4NO
2(g)═4NO(g)+CO
2(g)+2H
2O(g)△H=-574kJ/mol
CH
4(g)+4NO(g)═2N
2(g)+CO
2(g)+2H
2O(g)△H=-1160kJ/mol
写出CH
4还原NO
2至N
2的热化学方程式
.



