
【题目】将4 g NaOH固体溶解在水里,配得1 L溶液,从中取出10 mL,这10 mL溶液的物质的量浓度是( )
A. 1 mol·L-1 B. 0.1 mol·L-1 C. 0.01 mol·L-1 D. 10 mol·L-1
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】H2S在O2中不完全燃烧生成S和H2O。下列说法正确的是
A. 反应中的H2S和O2的总能量高于S和H2O的总能量 B. 微粒半径:O2-> S2-
C. 该反应中反应物的化学能全部转化为热能 D. 非金属性:S > O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述,能肯定判断某化学平衡发生转移的是
A.反应混合物的浓度改变
B.反应混合物中各组分的含量改变
C.正、逆反应速率改变
D.反应物的转化率改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淡黄色粉末物质A有以下转化关系:
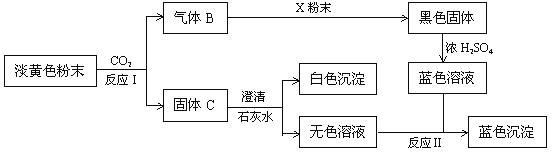
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是___________, X粉末是___________。
(2)写出反应Ⅰ的化学方程式____________________________________________。
(3)写出反应Ⅱ的离子方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)( )
A.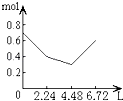
B.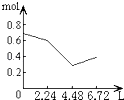
C.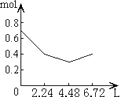
D.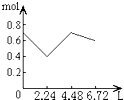
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2min的平均速率v(Z)=2.0×10—3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C. 该温度下此反应的平衡常数K=144
D. 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证哪位同学的判断正确,丙同学设计了如图1所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去).试回答: 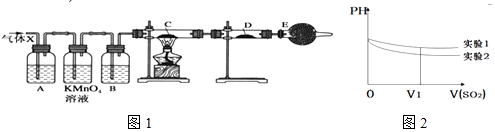
(1)上述反应中生成二氧化硫的化学方程式为 .
(2)乙同学认为还可能产生氢气的理由是 .
(3)A中加入的试剂可能是 , 作用是;B中加入的试剂可能是 , 作用是;
(4)可以证明气体X中含有氢气的实验现象是:C中: , D中: .
(5)II.该小组同学将收集的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2 , 该小组提出了如下假设: 假设一:溶液中的NO3﹣
假设二:溶液中溶解的O2
该小组设计实验验证了假设一,
请在下表空白处填写相关实验现象
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(6)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图2,实验1中溶液pH变小的原因是V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是基本有机合成原料,广泛用于医药、冶金和化工等部门。某校课外小组的同学拟利用乙炔合成H2C2O4·2H2O。回答下列问题:
(1)甲组的同学拟用电石(主要成分CaC2,含CaS和Ca3P2等杂质)制取C2H2[反应方程式为CaC2 +2H2O=Ca(OH)2 +C2H2(g) △H<0,该反应剧烈],实验装置如下:
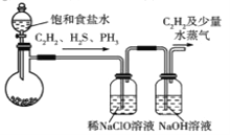
A B C
①装置A中,为减小产生乙炔的速率,除用饱和食盐水代替水外,还可采取的措施是_____(举一例)。
②装置A中,Ca3P2与水反应的化学方程式为_______________________________________;
装置B中,NaClO被还原为氯化钠,反应过程中还有极少量Cl2生成。写出H2S被NaClO溶液氧化为硫酸的主要反应的离子方程式:___________________________。
③装罝C中NaOH溶液的作用是___________________________________________________。
(2)乙组的同学拟用甲组制取的乙炔与浓硝酸在Hg(NO3)2催化下反应,并经结晶和重结晶得H2C2O4·2H2O。制备装置如下:
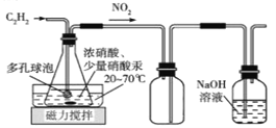
D E F
①装置D中多孔球泡的作用是___________________________________________;装置E的作用是__________________________________________________________;
②装置D生成H2C2O4 反应的化学方程式为______________________________________。
(3)丙组的同学拟设计实验证明草酸具有还原性。简单的实验方案为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com