
 某位同学在查阅资料时发现含氮化合物有以下性质:
某位同学在查阅资料时发现含氮化合物有以下性质:分析 本题为探究题,探究浓硝酸与铜、银等不活泼金属反应时除生成NO2气体外还有少量NO生成,涉及NO2与N2O4间的转化,及NO很容易被空气中的氧气氧化等性质,解题关键是消除彼此间的干扰,据此分析解答;
(1)装置中本身有空气,NO很容易被氧化;定量实验,需要确保生成物能完全测定,E装置就是为了吸收生成的氮氧化物的;
(2)NO遇氧气很容易生成NO2,现象是无色变为红棕色;
(3)装置C中收集到的是N2O4,E中增重的质量应该是NO和O2的质量,可结合电子守恒计算固体中Cu或银的质量,根据原子守恒及电荷守恒计算反应后溶液A中HNO3的浓度;
(4)铜、银均能溶解在FeCl3溶液里,但银可以转化为氯化银沉淀,因此只有知道生成氯化银的质量,就可以确定混合物中各组分的含量.
解答 解:(1)利用通入的空气将装置内的空气排尽,防止NO被氧化;第四步通N2的目的是将生成的NO和O2的混合气体完全被E中NaOH溶液吸收,故答案为:排尽装置中的空气,防止生成的NO被氧化;保证反应产生的气体完全被装置E吸收;
(2)欲验证NO可利用NO遇氧气变红棕色的性质,只要打开K2,持续通入氧气,D中出现红棕色气体即可证明,故答案为:打开K2,持续通入氧气,D中出现红棕色气体;
(3)N2O4的物质的量为$\frac{3.22g}{92g/mol}$=0.035mol,根据4NO+3O2+2H2O=4HNO3,设NO的物质的量为nmol,则O2的物质的量为0.75nmol,30n+32×0.75n=0.54,解得:n=0.01mol,设Cu的物质的量为xmol,银的物质的量为ymol,则64x+108y=7,另外电子守恒式为:2x+y=0.035×2+0.01×3,解得:x=0.025mol,y=0.05mol,则Cu的质量为0.025mol×64g/mol=1.6g,则铜的质量分数为$\frac{1.6g}{7g}×100%$=22.9%;被还原的硝酸为0.035mol×2+0.01mol=0.08mol,实际消耗的HNO3为0.08mol+2x+y=0.18mol,剩余硝酸为13.5mol/L×0.1L-0.18mol=1.17mol,实验后A中硝酸的浓度为:$\frac{1.17mol}{0.1L}$=11.7mol/L; 故答案为:22.9%;11.7;
(4)根据反应Ag+FeCl3?AgCl+FeCl2可知;当FeCl3溶液足量时固体完全溶解,生成的沉淀为AgCl,只要知道沉淀质量,Ag的质量即可求算,再结合固体的总质量,就可以计算合金中铜的质量分数,故答案为:反应中产生沉淀的质量.
点评 本题以探究铜、银与硝酸反应产物为载体,考查了氧化还原发生过程中的电子守恒规律,以及化学反应中的原子守恒、溶液中的电荷守恒等,另外涉及物质的鉴别,考查较为综合,中等难度.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | a | |||||||
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 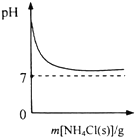 表示向NH3•H2O溶液中逐步加入NH4Cl固体后,溶液pH的变化 | |
| B. | 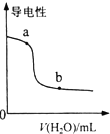 表示向NH3•H2O溶液中加水时溶液的导电性变化,则NH3•H2O溶液的pH:b>a | |
| C. | 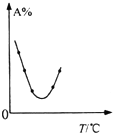 表示等量A在容积相同的恒容密闭容器中,不同温度下分别发生反应:2A(g)?B(g)+C(g),相同时间后测得A含量的曲线,则该反应的△H<0 | |
| D. | 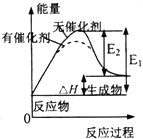 表示催化剂能改变化学反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子由Pt电极流出,经外电路流向NiO电极 | |
| B. | Pt电极上发生的是还原反应 | |
| C. | NiO电极的电极反应式为NO+O2--2e-═NO2 | |
| D. | 每转移2 mol电子,有1 mol O2-迁移到负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在pH为6.37及10.25时,溶液中c(CO32-)=c(HCO3-)=c(H2CO3) | |
| B. | 反应HCO3-+H2O═H2CO3+OH- 的平衡常数为10-10.25 | |
| C. | 0.1mol•L-1NaHC2O4溶液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | 往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4═HC2O4-+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下Mg2+得电子的能力比Rb+弱 | |
| B. | MgCl2对热的稳定性比RbCl强 | |
| C. | 在一定条件下,Mg的金属性比Rb强 | |
| D. | 铷的沸点比镁低,及时抽走铷蒸气使平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com