
���� ��ȡ������Һ������KSCN��Һ�������Ա仯��˵������Fe3+��
����ȡ��Һ�����������ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ����ɫ����ΪiNO������Fe2+��NO3-������CO32-��SiO32-��
����������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɣ�˵������SO42-��
������������õ���Һ�м������Ũ��ˮ�����к��ɫ�������ɣ����ˣ���������Һ�м�������������ʱ���ټ�������������Һ������ɫ�������ɣ�˵������Cu2+���Դ˽����⣮
��� �⣺��ȡ������Һ������KSCN��Һ�������Ա仯��˵������Fe3+��
����ȡ��Һ�����������ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ����ɫ����ΪiNO������Fe2+��NO3-������CO32-��SiO32-��
����������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɣ�˵������SO42-��
������������õ���Һ�м������Ũ��ˮ�����к��ɫ�������ɣ����ˣ���������Һ�м�������������ʱ���ټ�������������Һ������ɫ�������ɣ�˵������Cu2+��
��1�������Ϸ�����֪һ������Fe2+��Cu2+��NO3-��SO42-��һ������Fe3+��CO32-��SiO32-���ʴ�Ϊ��Fe2+��Cu2+��NO3-��SO42-��Fe3+��CO32-��SiO32-��
��2��ʵ����м�������������������NO����Ӧ�����ӷ���ʽΪ3Fe2++NO3-+4H+�T3Fe3++NO��+2H2O���ʴ�Ϊ��3Fe2++NO3-+4H+�T3Fe3++NO��+2H2O��
��3����Ӧ���������͵����������Ϊ1��4������ƽ����ʽΪ��16Al+9NO3-+7OH-=16AlO2-+4N2��+NH3��+2H2O�����ϼ۽��͵�������Ϊ��ԭ�����NH3��N2������֪0.2molNO3-��
16Al+9NO3-+7OH-=16AlO2-+4N2��+NH3��+2H2O
16 9
n��Al�� 0.2mol
n��Al��=$\frac{3.2}{9}$mol
��Al������Ϊ $\frac{3.2}{9}$mol��27 g•mol-1=9.6g��
�ʴ�Ϊ��NH3��N2��9.6��
���� ���⿼��������ƶϣ����ؿ��鳣�����ӵļ��鷽������Ŀ�Ѷ��еȣ���ȷ�������ӵ�����Ϊ���ؼ���ע���������ճ������ӵļ��鷽������������������ѧ���ķ������������Ӧ��������


 �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢ� | B�� | �ۢܢ� | C�� | �٢ڢ� | D�� | �٢ۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
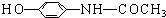 ���й��ڸ����ʵ�����������ȷ���ǣ�������
���й��ڸ����ʵ�����������ȷ���ǣ�������| A�� | �û��������ʽΪC8H9O2N | |
| B�� | �ܺ�������Һ����������Ӧ | |
| C�� | �ܺ��������Ʒ�����Ӧ | |
| D�� | ������е�ԭ�Ӳ����ܶ���ͬһƽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
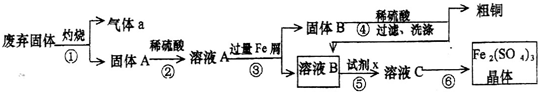
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��ʾ��װ�ý��е�⣮ͨ��һ���������ʪ��ĵ���KI��ֽ��C�˱�Ϊ��ɫ��
��ͼ��ʾ��װ�ý��е�⣮ͨ��һ���������ʪ��ĵ���KI��ֽ��C�˱�Ϊ��ɫ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
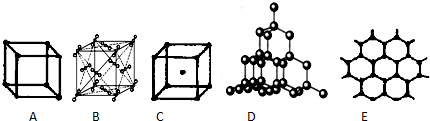
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��һ�������£�����ؿ��к������ķǽ���Ԫ��X��������ֳ����Ļ������X��O�����ֻ���������еĻ�ѧ��Ϊ���ۼ�
��һ�������£�����ؿ��к������ķǽ���Ԫ��X��������ֳ����Ļ������X��O�����ֻ���������еĻ�ѧ��Ϊ���ۼ�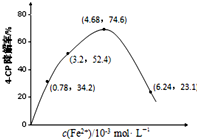
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu��Cu2+ | B�� | SO32-��SO2 | C�� | Fe2O3��Fe | D�� | MnO4-��Mn2+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com