
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是( )
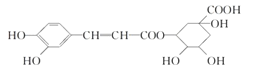
A.1mol 绿原酸与足量 NaHCO3 溶液反应,生成 3molCO2 气体
B.1mol 绿原酸与足量 Na 反应,最多消耗 6molNa
C.1mol 绿原酸与足量 NaOH 溶液反应,最多消耗 3molNaOH
D.绿原酸水解产物均可以与 FeCl3 溶液发生显色反应
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】制取氯化铁粉末所需装置如下,已知氯化铁粉末很容易吸水生成结晶化合物:FeCl3+6H2O=FeCl3·6H2O。
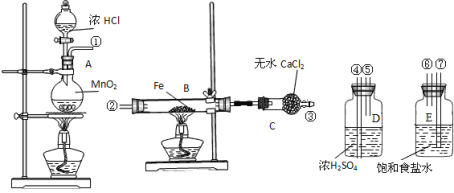
(1)按照气体流向从左到右顺序连接仪器应是①接_____,____接______,____接_______。
(2)烧瓶A中发生的反应_________________,B中反应的现象是____________。
(3)容器D的作用是_______,容器E的作用是_________。
(4)实验时应先点燃__处(填“A”或“B”)的酒精灯,理由是___________________________。
(5)这套实验装置是否完整?___(填“是”或“否”),若不完整,还须补充___________装置(若第一问填“是”,则此问不需要作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁溶液可腐蚀印刷电路板上的铜膜,某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为溶液作为腐蚀液原料循环使用,设计了如下实验步骤:
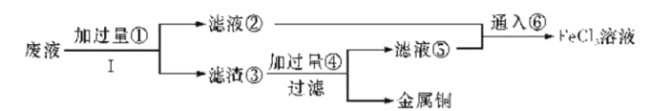
(1)写出下列物质的化学式①__、③___、⑥__。
(2)步骤Ⅰ的操作名称:___。
(3)写出FeCl3溶液与铜发生反应的离子方程式:__。
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为___色沉淀,此过程所涉及反应的化学方程式为:___、___。
(5)通入⑥发生反应的离子方程式:___。
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是__(填字母代号)。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B.1 mol Cl2中含有的原子数为NA
C.标准状况下,aL氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D.常温常压下,11.2 L CO分子数是0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下硫酸亚铁分解反应为2FeSO4![]() Fe2O3+SO2↑+SO3↑,下列说法不正确的是
Fe2O3+SO2↑+SO3↑,下列说法不正确的是
A.将产生的气体,通入紫色石蕊试液后溶液只变红不褪色
B.将反应后残留固体物质用盐酸溶解,再加入KMnO4溶液后褪色,说明硫酸亚铁固体分解完全
C.将少量产生的气体,分别通入含有NaOH的BaCl2溶液和含有氨水的BaCl2溶液中均产生白色沉淀,且沉淀成分相同
D.在实际实验操作过程将产生的气体通入品红溶液后溶液颜色先加深后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 中的一种或几种,将该混合物进行如下实验:
中的一种或几种,将该混合物进行如下实验:
①将少许混合物放入水中得到无色溶液和白色沉淀,过滤;
②取溶液进行焰色反应,火焰呈黄色;
③取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体
由上述现象推断:
(1)该混合物中一定含有________,一定不含有________,可能含有________。
(2)若要检验可能含有的物质是否存在,可以采用的实验操作为_____(填写字母)。
A.取步骤①中滤液,加入![]() 溶液
溶液
B.取步骤①中滤液,加入NaOH溶液
C.取步骤①中滤液,加入足量![]() 溶液,静置后在上层清液中加入硝酸酸化
溶液,静置后在上层清液中加入硝酸酸化![]() 溶液
溶液
D.取步骤①中滤液,加入足量![]() 溶液,静置后上层清液中加入硝酸酸化
溶液,静置后上层清液中加入硝酸酸化![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯、乙醛为原料,AlCl3 为催化剂制备 1,1–二苯乙烷,其反应原理为:
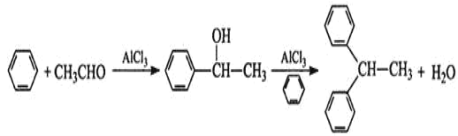
已知:AlCl3 固体遇水会发生较强烈水解。 I.制取装置如图所示。
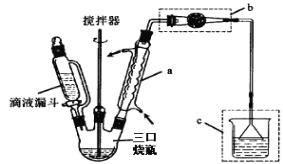
(1)该反应需控制反应温度为 20℃。控制 20℃的方法是________ ;该反应不高于 20℃ 的可能原因是:_______ 。
(2)仪器 a 的名称是 __________ 作用是 _________ ;装置 c 的作用是吸 收 HCl,写出产生 HCl 的化学方程式 ________;装置 b 的作用是 _____________ 。
Ⅱ.实验结束后,将三口烧瓶中的混合物倒入冷稀盐酸中,用分液漏斗分离出有机层,依 次用水、2%碳酸钠溶液、水洗涤,洗涤后加入少量无水硫酸镁固体,过滤、蒸馏,得到 1, 1–二苯乙烷。
(3)分液漏斗中,产品在____(填“上”或“下”)层;洗涤操作中,第二次水洗的目的 是____;无水硫酸镁也可用物质 ______________ 代替。
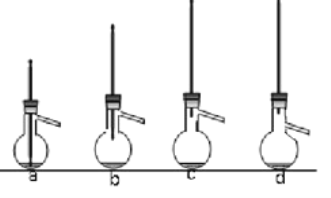
(4)蒸馏提纯时,下列装置中会导致收集到的产品中混有低沸点杂质的装置是______ (选填编号)。
(5)三口烧瓶中加入 120mL 苯(密度 0.88g/mL)、19g A1C13 和 3.7g 乙醛,20℃时充分反应, 制得纯净的 1,1–二苯乙烷 7.8g。该实验的产率约为 ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,已知Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
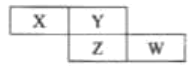
A.X、Y、Z和W均可以与氢元素形成18电子的共价化合物
B.简单离子半径:W<Z<Y<X
C.氧化物对应水化物的酸性:W>Z
D.Y与Z均为非金属,两者不能形成化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是常温下几种常见弱酸的电离平衡常数:
弱酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | K=1.6×10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9×10-2 K2=6.4×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2S | H2S HS- | K1=9.1×10-8 K2=1.1×10-15 |
回答下列问题:
(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则由水电离出的c(H+)为___mol·L-1。
(2)下列四种离子结合H+能力最强的是___。
A.HCO3- B.C2O42- C.S2- D.CH3COO-
(3)常温下1.0mol·L-1的CH3COOH溶液中的c(H+)=___mol·L-1。
(4)常温下,加水稀释0.1mol·L-1的H2C2O4溶液,下列说法正确的是___。
A.溶液中n(H+)·n(OH-)保持不变
B.溶液中水电离的c(H+)·c(OH-)保持不变
C.溶液中![]() 保持不变
保持不变
D.溶液中c(OH-)增大
(5)将CH3COOH溶液加入少量Na2CO3溶液中,反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com