
【题目】硼及其化合物广泛应用于高新材料领域,请回答下列有关问题:
(1)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图)。
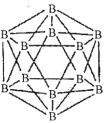
①在基态11B原子中,核外存在______对自旋相反的电子。
②若每个单元中有两个原子为l0B,其余为11B,则该单元结构的类型有______种。
(2)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由小到大的顺序为________,BH4-离子的空间构型是_____________,与BH4-互为等电子体的的分子有___________。
(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、_____、_______。与H3BO3酸性最接近的是__________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
(4)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞,B原子的杂化方式是___________。立方相氮化硼晶体的熔点要比磷化硼体高,其原因是_____________。
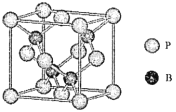
(5)己知磷化硼的晶胞参数a=478 pm,请列式计算该晶体的密度p=_____g.cm-3(用含NA的代数式表示即可,不需要计算出结果)。晶胞中硼原子和磷原子最近的核间距为_________pm。
【答案】 2 3 Na<B<H 四面体形 CH4 氢键 范德华力 A sp3 二者均为原子晶体,氮原子的半径小于磷原子, N-B 键的键长小于 P-B 键, N-B 键的键能大 ![]()
![]()
【解析】试题分析:(1)①同一个轨道中的电子自旋相反。
②根据两个l0B原子在晶胞中的相对位置分析,当选定1个顶点后,与它最近的顶点数为5个,然后就是5个,最远的是1个,即二取代物有3种。
(2) 根据NaBH4中H元素显负极、钠的活泼性大于B分析电负性,根据价电子理论分析BH4-离子的空间构型,等电子体是原子数相同、价电子数也相同的微粒。
(3)石墨中存在的作用力有共价键、分子间作用力,硼酸中含有O、H原子,所以存在氢键。B与Si的性质符合对角线原则。
(4)根据是磷化硼晶体的晶胞每个B原子与4个P原子成键,B原子的杂化方式是sp3 。立方相氮化硼晶体的熔点要比磷化硼体高,N原子的半径小于P,N-B键能大于B-P。
(5)己知磷化硼的晶胞参数a=478 pm,根据![]() 计算晶体的密度。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm
计算晶体的密度。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm![]()
![]() , 478 pm
, 478 pm![]()
![]() ,478 pm
,478 pm![]()
![]() )。478 pm
)。478 pm![]()
![]()
解析:(1)①同一个轨道中的电子自旋相反,B原子核外电子排布为1S22S22P1,核外存在2对自旋相反的电子。
②根据两个l0B原子在晶胞中的相对位置分析,当选定1个顶点后,与它最近的顶点数为5个,然后就是5个,最远的是1个,即二取代物有3种。
(2) 根据NaBH4中H元素显负极、钠的活泼性大于B,,所以电负性Na<B<H,根据价电子理论BH4-离子的价电子对数是![]() ,无孤对电子,所以空间构型为四面体形,等电子体是原子数相同、价电子数也相同的微粒,与BH4-互为等电子体的的分子有CH4。
,无孤对电子,所以空间构型为四面体形,等电子体是原子数相同、价电子数也相同的微粒,与BH4-互为等电子体的的分子有CH4。
(3)石墨中存在的作用力有共价键、分子间作用力,硼酸中含有O、H原子,所以存在氢键,硼酸晶体中存在的作用力有共价键、分子间作用力、氢键。B与Si的性质符合对角线原则,所以与H3BO3酸性最接近的是H4SiO4。
(4)根据是磷化硼晶体的晶胞每个B原子与4个P原子成键,B原子的杂化方式是sp3 。立方相氮化硼晶体的熔点要比磷化硼体高,N原子的半径小于P,N-B键能大于B-P,所以立方相氮化硼晶体的熔点要比磷化硼体高。
(5)根据均摊原则1个晶胞含有一个晶胞含有4个B,4个P,设有1mol晶胞,则体积为![]() ,质量为42
,质量为42![]() g,根据
g,根据![]() ,晶体的密度为
,晶体的密度为![]() =
=![]() 。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm
。设某个顶点上的P原子坐标为(0,0,0),则离这个P原子最近的B原子指标为(478 pm![]()
![]() , 478 pm
, 478 pm![]()
![]() ,478 pm
,478 pm![]()
![]() ),所以晶胞中硼原子和磷原子最近的核间距为
),所以晶胞中硼原子和磷原子最近的核间距为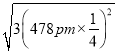 =
=![]() 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)( )
A.溴苯(溴):加NaOH溶液,分液
B.乙烷(乙烯):通入溴水,洗气
C.乙酸(水):加新制生石灰,蒸馏
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某同学设计的木炭和浓硫酸反应并检验所得全部产物的实验装置.已知酸性高锰酸钾溶液具有强氧化性,可将S元素从+4价氧化为+6价.请回答: 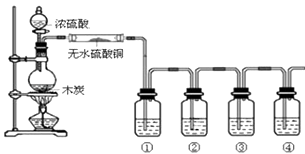
(1)装置中盛浓硫酸的仪器名称是;实验过程中大玻璃管内无水硫酸铜表面的现象是;图中4个洗气瓶装有的试剂请从下列药品中选择:澄清石灰水;酸性高锰酸钾溶液;品红溶液;(可重复选用)试指出各洗气瓶内试剂名称① , ② , ③ , ④ .
(2)检验所得产物含SO2的实验现象为
(3)检验所得产物含CO2的实验现象为 .
(4)写出木炭和浓硫酸反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe、Cu与含Fe2+、Fe3+和Cu2+的溶液置于同一容器中,充分反应后Fe有剩余,则容器中一定有
A. Cu、Fe3+ B. Fe2+、Fe3+ C. Fe2+、Cu2+ D. Cu、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素和硫元素组成的两种物质发生化学反应的微观示意图如下所示,其中●表示硫原子,○表示氧原子. 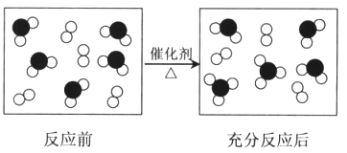
请回答下列问题:
(1)该反应的化学方程式是 .
(2)反应过程中,O2的浓度在5min内由5mol/L变成了1mol/L,用O2表示的化学反应速率是mol/(Lmin).
(3)在等温等容条件下,该反应达到化学平衡状态的依据是(填序号).
a.容器中压强不再改变
b.混合气体中c(O2)不再改变
c.c(SO2)=c(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能存在Br-、CO![]() 、SO
、SO![]() 、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O===10HCl+2HIO3
据此可以判断:该溶液肯定不存在的离子组是
A. Al3+、Mg2+、SO![]() B. Mg2+、CO
B. Mg2+、CO![]() 、I-
、I-
C. Al3+、SO![]() 、I- D. Al3+、Br-、SO
、I- D. Al3+、Br-、SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com