
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题: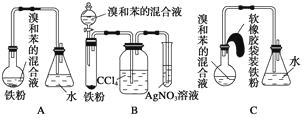
(1)写出三个装置中所共同发生的两个反应的化学方程式:;。
写出B中盛有AgNO3溶液的试管中所发生反应的化学方程式:。
(2)装置A和C均采用了长玻璃导管,其作用是。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是;
应对装置C进行的操作是。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是。
(5)B中采用了洗气瓶吸收装置,其作用是 , 反应后洗气瓶中可能出现的现象是。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是。
【答案】
(1)2Fe+3Br2=2FeBr3;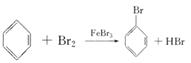 ;HBr+AgNO3=AgBr+HNO3
;HBr+AgNO3=AgBr+HNO3
(2)导出HBr,兼起冷凝回流的作用
(3)旋转分液漏斗的活塞,使溴和苯的混合液滴到铁粉上;托起软橡胶袋使铁粉落入溴和苯组成的混合液中
(4)Br2和苯的蒸气逸出;污染环境
(5)吸收反应中随HBr逸出的Br2和苯蒸气;CCl4由无色变成橙红色
(6)随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低;由于导管插入AgNO3溶液中而易产生倒吸
【解析】苯在铁粉作用下,可与液溴发生取代反应生成Br,同时生成 ![]() ,故可用AgNO3溶液(HNO3酸化)来检验反应生成的HBr,进而证明确实发生了取代反应,但该反应放热,Br2、苯又易挥发,Br2与H2O反应生成HBr、HBrO,会干扰有关的实验现象。此外,苯、Br2进入空气中会造成污染,同时也使反应物的利用率降低。
,故可用AgNO3溶液(HNO3酸化)来检验反应生成的HBr,进而证明确实发生了取代反应,但该反应放热,Br2、苯又易挥发,Br2与H2O反应生成HBr、HBrO,会干扰有关的实验现象。此外,苯、Br2进入空气中会造成污染,同时也使反应物的利用率降低。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃的混合物9g,其密度是相同条件下氢气密度的11.25倍,当混合气体通过足量溴水时,溴水增重4.2g,则这两种气态烃是( )
A.甲烷和乙烯
B.乙烷和乙烯
C.甲烷和丙烯
D.甲烷和丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铁粉放入稀硫酸溶液:2Fe+6H+═2Fe3++3H2↑
B.往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
C.石灰石与稀盐酸反应:CO32﹣+2H+═CO2↑+H2O
D.Cl2通入水中:Cl2+H2OH++Cl﹣+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是 , 向其中加入少量KOH溶液时,发生反应的离子方程式是;
(2)现将0.04molL﹣1HA溶液和0.02molL﹣1NaOH溶液等体积混合,得到缓冲溶液.
①若HA为HCN,该溶液显碱性,则溶液中c(Na+)c(CN﹣)(填“<”、“=”或“>”),你得出该结论的依据是;该混合溶液的质子守恒式是 .
②若HA为CH3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是 . 该混合溶液的物料守恒式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科研小组的同学在精确测试Na2SO3溶液的pH时,遇到了困惑.为此,他们进行了冷静的思考和准备,决心重新实验,揭开奥秘.请你了解情况,参与交流讨论.
[查阅资料]①常温下0.1molL﹣1的H2SO3溶液的pH约为2.1.
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸.常温下0.1molL﹣1的H2S溶液的pH约为4.5.
[实验操作]①准确称取纯净的Na2SO37H2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重(只有硫元素的化合价变化成最高价和最低价),质量为12.60g.
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异.将其溶于水得250mL溶液,测得pH=10.3.
[分析猜想]Na2SO37H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中除坩埚、酒精灯、三角架及隔绝空气的设备外,还需要的仪器有 .
(2)给Na2SO37H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明. .
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是 .
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是 . 实验③中溶液的pH=10.3的原理是(以相关的离子方程式表示) .
(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证.请简单叙述实验步骤、现象和结论. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液与K2C2O4溶液混合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物.通过下述实验确定该晶体的组成.
步骤a:称取0.6720g样品,放入锥形瓶,加入适量2molL﹣1稀硫酸,微热使样品溶解.再加入30mL水加热,用0.2000molL﹣1 KMnO4溶液滴定至终点,消耗8.00mLKMnO4溶液.
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色.冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI.用0.2500molL﹣1 Na2S2O3标准溶液滴定至终点,消耗8.00mLNa2S2O3溶液.
已知涉及的部分反应的离子方程式为:
步骤a:2MnO4﹣+5C2O42﹣+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I﹣=2CuI↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
(1)已知室温下CuI的Ksp=1.27×10﹣12 , 欲使溶液中c(Cu+)≤1.0×10﹣6molL﹣1 , 应保持溶液中c(I﹣)≥molL﹣1 .
(2)MnO4﹣在酸性条件下,加热能分解为O2 , 同时生成Mn2+ .
写出该反应的离子方程式为 .
若无此加热操作,则测定的Cu2+的含量将会(填“偏高”、“偏低”或“不变”).
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为 .
(4)通过计算确定样品晶体的组成.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量之比为1:2的是( )
A.3S+6NaOH═2Na2S+Na2SO3+3H2O
B.2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2
C.I2+2NaClO3═2NaIO3+Cl2
D.4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X,Y为两个电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列叙述正确的是( ) 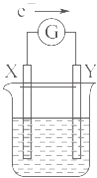
A.外电路中的电流方向为:X→外电路→Y
B.若两个电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C.若两个电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3 , 向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示.则溶液中Fe(NO3)3、Cu( NO3)2、HN03物质的量浓度之比为( ) 
A.1:1:1
B.1:3:1
C.2:1:4
D.1:1:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com