
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
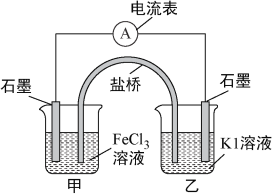
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上Fe3+被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
【答案】D
【解析】
由反应2Fe3+ +2I- ![]() 2Fe2+ +I2可知,反应开始时,甲中Fe3+发生还原反应,乙中I-发生氧化反应;当电流计读数为零时,则反应达到了平衡状态,此时在甲中溶入FeCl2固体,平衡向逆反应方向移动,乙中I2发生还原反应,则乙中石墨电极为正极。
2Fe2+ +I2可知,反应开始时,甲中Fe3+发生还原反应,乙中I-发生氧化反应;当电流计读数为零时,则反应达到了平衡状态,此时在甲中溶入FeCl2固体,平衡向逆反应方向移动,乙中I2发生还原反应,则乙中石墨电极为正极。
A.反应开始时乙中石墨电极上I-被氧化成I2,发生了氧化反应,故A正确。B.反应开始时,甲中石墨电极上Fe3+被还原成Fe2+,故正B确;C.当电流计读数为零时,则反应达到了平衡状态,故C正确。D. 电流计读数为零后,在甲中溶入FeCl2固体,则甲中Fe2+浓度变大,发生氧化反应,甲为负极,故D错误。答案:D。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
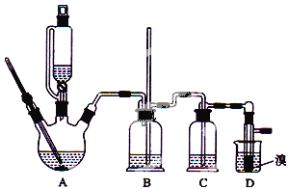
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此实验中,反应方程式为:_________;________。
(2)要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用_________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(5)判断该制备反应已经结束的最简单方法是_____________;
(6)反应过程中应用冷水冷却装置D,其主要目的是________________;但又不能过度冷却(如用冰水),其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:Mo基催化剂的耐硫甲烷化反应会涉及WGS 或者RWGS 反应,主要反应式如下:
(1)CO和CO2甲烷化 CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH1=-206.2kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH2=-165.0kJ/mol
写出CO 与水蒸气反应生成CO2和H2的热化学方程式__________________________________。
(2)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
 ,
,
①该反应的ΔH__________0 (选填“<”、“>”或“=”)。
②在500℃条件下达平衡时CO 的转化率为______________________。
③计算在300℃条件下达平衡时K=________________________。
④将容器d 中的平衡状态转变到容器c中的平衡状态,可采取的措施有______________________。
Ⅱ:某电解装置如图所示,X、Y 均为惰性电极:
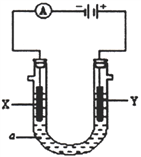
(3)若a溶液为滴有酚酞试液的NaNO3溶液,通电一段时间后X 电极及周围溶液的现象是:________________________________,Y 电极的电极反应式为______________________。
(4)若a 溶液为饱和CuCl2溶液,当电路中有0.2 mol 的电子通过时,阴、阳两电极的质量之差是__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4种有机化合物之间存在下列转化关系。

(1)在上述4种有机化合物中,属于烃的是________(填名称),其分子中的官能团是________。
(2)反应②的实验中用到Cu丝,其作用是作________剂。
(3)反应③的反应类型属于________反应,该反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。如图是工业上提镁的流程。
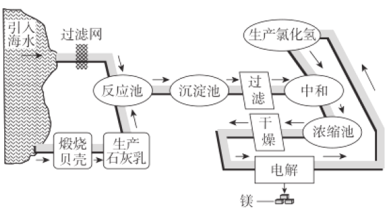
(1)电解熔融MgCl2制金属镁的化学方程式是________。
(2)“反应池’→……→‘中和’”过程的主要作用:①除去海水中的其他杂质;②________。
(3)“中和”时,Mg(OH)2与盐酸发生反应的离子方程式是________。
(4)在上述流程中,可循环使用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向一定浓度的Na2C2O4溶液中滴加盐酸,混合溶液的pH与离子浓度变化关系如图所示。已知H2C2O4是二元弱酸,X表示 ,下列叙述错误的是
,下列叙述错误的是

A.从M点到N点的过程中,c(H2C2O4)逐渐增大
B.直线n表示pH与 的关系
的关系
C.由N点可知Ka1 (H2C2O4)的数量级为10 -2
D.pH=4.18的混合溶液中:c(Na+)>c(HC2O4-)= c(C2O42-) =c(Cl-)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定体积的某NaOH溶液分成两等份,一份用![]() 的一元酸HA溶液中和,消耗酸溶液的体积为
的一元酸HA溶液中和,消耗酸溶液的体积为![]() ;另一份用
;另一份用![]() 的一元酸HB溶液中和,消耗酸溶液体积为
的一元酸HB溶液中和,消耗酸溶液体积为![]() ,则下列叙述正确的是
,则下列叙述正确的是![]()
![]()
A.若![]() ,则说明HA的酸性比HB的酸性强
,则说明HA的酸性比HB的酸性强
B.若![]() ,则说明HA的酸性比HB的酸性弱
,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故![]() 一定等于
一定等于![]()
D.若将两种酸溶液等体积混合,混合溶液的pH一定等于2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ![]()
A.某二元酸![]() 在水中的电离方程式是:
在水中的电离方程式是:![]() ,
,![]() ;则NaHA溶液中:
;则NaHA溶液中:![]()
B.相同温度下将足量氯化银固体分别放入相同体积的①蒸馏水、②![]() 盐酸、③
盐酸、③![]() 氯化镁溶液、④
氯化镁溶液、④![]() 硝酸银溶液中,
硝酸银溶液中,![]() 为①>④=②>③
为①>④=②>③
C.常温下,某溶液的![]() ,则该物质一定是酸或强酸弱碱盐
,则该物质一定是酸或强酸弱碱盐
D.若![]() 、
、![]() 、
、![]() 分别表示常温下
分别表示常温下![]() 的电离平衡常数、
的电离平衡常数、![]() 的水解平衡常数和水的离子积常数,则三者之间的关系为
的水解平衡常数和水的离子积常数,则三者之间的关系为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com