
分析 (1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;该反应的正反应是放热反应,降低温度,平衡正向移动,但平衡常数只与温度有关;
(2)该反应的正反应是一个反应前后气体体积减小的反应,增大压强,平衡向气体体积减小的方向移动;温度不变,平衡常数不变;
(3)达到平衡后,在恒压条件下,向容器中通入氦气,参加反应的气体分压减小,平衡向气体体积增大方向移动.
解答 解:(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,所以该反应的平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}).{c}^{3}({H}_{2})}$;该反应的正反应是放热反应,降低温度,平衡正向移动,则化学平衡常数增大,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}).{c}^{3}({H}_{2})}$;增大;
(2)该反应的正反应是一个反应前后气体体积减小的反应,增大压强,平衡向气体体积减小的方向移动,向正反应方向移动;温度不变,平衡常数不变,所以该反应平衡常数不变,故答案为:向正反应方向;不变;温度不变、化学平衡常数不变;
(3)达到平衡后,在恒压条件下,向容器中通入氦气,参加反应的气体分压减小,平衡向气体体积增大方向移动,所以逆向移动,氮气的转化率减小,故答案为:减小.
点评 本题考查化学平衡移动影响因素,为高频考点,明确温度、浓度、压强对化学平衡移动影响原理是解本题关键,注意:化学平衡常数只与温度有关,与物质浓度、混合气体压强都无关,题目难度不大.


科目:高中化学 来源: 题型:解答题
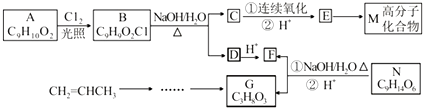
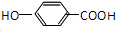 .
. .
.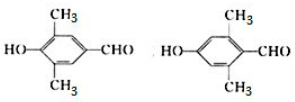 .
.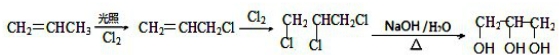 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开一个N≡N,同时有六个N-H键生成 | |
| B. | 生成氨的速率与分解氨的速率相等 | |
| C. | N2、H2,、NH3的质量分数不再变化 | |
| D. | 混合气体总压不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
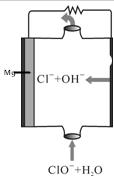
| A. | 电子由负极经电解质溶液移向正极 | |
| B. | ClO-参与的一极为正极 | |
| C. | 电池中镁为负极,发生氧化反应 | |
| D. | 放电过程中,溶液中Cl-的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
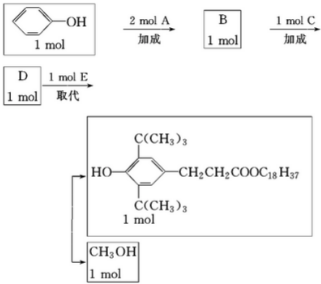
 +
+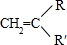 →
→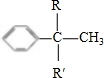
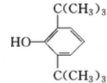 ,C:CH2=CHCOOCH3,D:
,C:CH2=CHCOOCH3,D: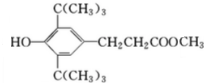 ,E:C18H37OH.
,E:C18H37OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00- | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
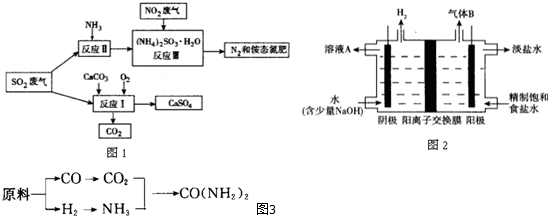
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com