
| A、氧化铁和稀盐酸:FeO+2H+=Fe2++H2O |
| B、向NaOH溶液中通Cl2:2OH-+Cl2=Cl-+ClO-+H2O |
| C、向AlCl3溶液中加过量强碱:Al3++3OH-=Al(OH)3↓ |
| D、给漂白粉溶液中加入盐酸:Ca(ClO2)+2H+=2HClO+Ca2+ |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
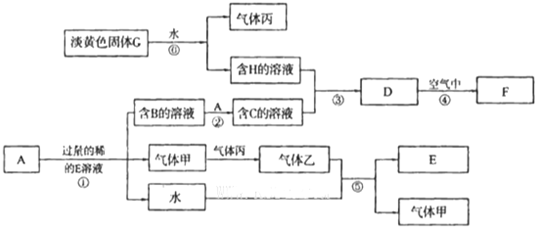
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气的体积为1.12L |
| B、原烧碱溶液中含溶质离子0.2NA |
| C、所得溶液中含OH-的数目为1×10-5NA |
| D、所得溶液中C1O-的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氟酸的电离过程是吸热的 |
| B、当V=20时,溶液中:c(F-)<c(Na+)=0.1mol?L-1 |
| C、当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-) |
| D、当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极发生的反应:2H++2e-=H2 |
| B、正极上的反应为:2Cl--2e-=Cl2 |
| C、阳极产生的气体能使湿润的淀粉-KI试纸变蓝 |
| D、电路中通过的电子数为6.02×1023时,共产生气体约11.2L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,4v正(O2)=5v逆(NO) |
| B、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C、达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减小,平衡正向移动 |
| D、化学反应速率关系是:2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、两个反应均为氧化还原反应 |
| B、CO2与SO2可以用澄清石灰水鉴别 |
| C、CO2分子中各原子最外层均为8电子稳定结构 |
| D、相同条件下:2CO(g)+SO2(g)═S(g)+2CO2(g)△H=-270kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com